题目内容
1.利用如图所示装置(电极均为惰性电极) 可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是( )
| A. | 气体W为氧气 | |
| B. | b极与电源的正极相连 | |
| C. | 离子交换膜c为阳离子交换膜 | |
| D. | a极的电极反应为SO2+2H2O-2e-=SO42-+4H+. |
分析 根据图知,右边装置中加入较稀的NaOH溶液,电解后得到较浓的NaOH溶液,说明b电极上发生的反应为2H2O-4e-=2H2↑+4OH-,所以b是阴极、a是阳极,左边装置中,加入稀硫酸和SO2,电解后得到较浓的硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+.
解答 解:根据图知,右边装置中加入较稀的NaOH溶液,电解后得到较浓的NaOH溶液,说明b电极上发生的反应为2H2O-4e-=2H2↑+4OH-,所以b是阴极、a是阳极,左边装置中,加入稀硫酸和SO2,电解后得到较浓的硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+;
A.通过以上分析知,b电极上得到的气体是H2,即w是H2,故A错误;
B.b是阴极,连接电源负极,故B错误;
C.a电极上生成氢离子,需要硫酸根离子形成硫酸,所以离子交换膜c阴离子交换膜,故C错误;
D.左边装置中,加入稀硫酸和SO2,电解后得到较浓的硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,侧重考查学生观察、分析判断、知识运用能力,明确各个电极上发生的反应、电极名称的判断是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.在恒温恒容密闭容器中,将CO和H2S混合并达到下列平衡:CO (g)+H2S (g)?COS (g)+H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol.下列说法正确的是( )
| A. | 若容器内压强不再变化,则说明该反应己达平衡 | |
| B. | 反应前H2S物质的量为2.5mol | |
| C. | CO和H2S达平衡后的转化率相同 | |
| D. | 若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
12.对于反应C(s)+H2O(g)?CO(g)+H2(g);△H>0,下列有关说法正确的是( )
| A. | 升高体系温度,平衡常数K减小 | |
| B. | 增大体系压强,平衡常数K不发生变化 | |
| C. | 平衡常数表达式为K=$\frac{[CO][{H}_{2}]}{[C][{H}_{2}O]}$ | |
| D. | 增加C(s)的量,平衡正向移动 |
9.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
下列说法不正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
16.下列各组中两个变化所发生的反应,属于同一类型的是( )
①由乙烯、氢气制取乙烷、由乙烷、溴(气体)制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由乙醇、乙酸制乙酸乙酯、由甘氨酸制得二肽
④由乙烯、氯化氢制取氯乙烷、由乙炔、氯化氢制取氯乙烯.
①由乙烯、氢气制取乙烷、由乙烷、溴(气体)制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由乙醇、乙酸制乙酸乙酯、由甘氨酸制得二肽
④由乙烯、氯化氢制取氯乙烷、由乙炔、氯化氢制取氯乙烯.
| A. | 只有②③ | B. | 只有③④ | C. | 只有①③ | D. | 只有①④ |
13.下列叙述错误的是( )
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 | |
| C. | 钢铁腐蚀时负极的电极反应式:Fe-3e-═Fe+ | |
| D. | 工业上电解饱和食盐水时阴极的电极反应式:2H++2e-═H2↑ |
10.下表是某矿泉水的部分标签说明

则该饮用水中还可能较大量存在的离子是( )

则该饮用水中还可能较大量存在的离子是( )
| A. | OH- | B. | Ag+ | C. | Na+ | D. | Ba2+ |
11.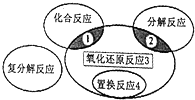 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2Na2HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | Zn+H2SO4═ZnSO4+H2↑ |