题目内容
9.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
分析 A.依据平衡常数随温度变化分析判断平衡移动方向,结合平衡移动原理判断;
B.依据浓度商和平衡常数比较判断反应进行的方向;
C.25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为Ni(s)+4CO(g)?Ni(CO)4(g),平衡常数的倒数;
D.依据平衡常数计算Ni(CO)4的平衡浓度;
解答 解:A.图表数据分析,平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,故A正确;
B.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,Qc=$\frac{c(Ni(CO)_{4})}{{c}^{4}(CO)}$=$\frac{0.5}{0.{5}^{4}}$=8>2,说明平衡逆向进行,则此时v(正)<v(逆),故B错误;
C.25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数与Ni(s)+4CO(g)?Ni(CO)4(g)互为倒数,平衡常数的倒数为$\frac{1}{5×1{0}^{4}}$=2×10-5,故C正确;
D.80℃达到平衡时,测得n(CO)=0.3mol,c(CO)=$\frac{0.3mol}{0.3L}$=1mol/L,依据平衡常数计算式,K=$\frac{c(Ni(CO)_{4})}{{c}^{4}(CO)}$=2,则Ni(CO)4的平衡浓度为2mol/L,故D正确;
故选B.
点评 本题考查了化学平衡移动原理的分析判断,平衡常数计算应用,掌握平衡常数随温度变化和浓度商与平衡常数比较判断平衡移动方向是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的三种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1 |
20.下列有关说法中,正确的是( )
| A. | 乙醇和乙醚互为同分异构体 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应 | |
| D. | 在酸性条件下,蔗糖水解的化学方程式为 C12H22O11+H2O→2C6H12O6(葡萄糖) |
17.下列有关有机物的实验操作、现象或结论不正确的是( )
| A. | 提纯含有杂质的工业乙醇,常用的方法是蒸馏 | |
| B. | 常温下,将二氧化碳通入苯酚钠溶液,溶液会变浑浊 | |
| C. | 混有泥沙的苯甲酸,除去杂质的方法是将其溶解后过滤,再蒸发结晶即可 | |
| D. | 苯和苯酚稀溶液分别与浓溴水混合,后者产生白色沉淀 |
4.将500mL pH=5的硫酸铜溶液(足量)用惰性电极电解一段时间,溶液pH变为2,若使溶液的浓度、pH与电解前相同,可采取的方法是( )
| A. | 向溶液中加入0.245g Cu(OH)2 | B. | 向溶液中加入0.31gCuCO3 | ||
| C. | 向溶液中加入0.0025 molH2SO4 | D. | 向溶液中加入0.2gCuO |
14.下列关于有机物说法正确的是( )
| A. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| B. | 石油分馏可获得甲烷、乙烯、苯等 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. |  已知上海世博会永久性标志建筑之-上海世博轴(如图)的上层巨型膜结构ETFE由单体乙烯和四氟乙烯加聚而成:其结构简式为: 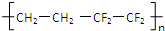 |
1.利用如图所示装置(电极均为惰性电极) 可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是( )

| A. | 气体W为氧气 | |
| B. | b极与电源的正极相连 | |
| C. | 离子交换膜c为阳离子交换膜 | |
| D. | a极的电极反应为SO2+2H2O-2e-=SO42-+4H+. |
19.30mL 0.2mol/L KCl溶液与20mL 0.1mol/L AlCl3溶液中Cl-物质的量浓度之比是( )
| A. | 1:1 | B. | 2:3 | C. | 2:1 | D. | 3:1 |
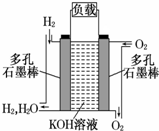 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: .
.