题目内容
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 无色透明的水溶液中:Mg2+、H+、Cl-、SO42- |
分析 A.滴入石蕊试液显蓝色的溶液,显碱性;
B.离子之间发生氧化还原反应;
C.NaAlO2溶液,显碱性;
D.该组离子之间不反应.
解答 解:A.滴入石蕊试液显蓝色的溶液,显碱性,不能大量存在HSO3-,且HSO3-、ClO-发生氧化还原反应,故A错误;
B.Fe(NO3)3与I-发生氧化还原反应,不能共存,故B错误;
C.NaAlO2溶液,显碱性,不能大量存在H+,故C错误;
D.该组离子之间不反应,可大量共存,且离子均为无色,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
13.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知:
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1059.3 kJ/mol | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g);△H=-1076.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=-1076.7 kJ/mol |
10.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | NH3 | B. | PCl3 | C. | PCl5 | D. | BCl3 |
8.下列化学实验事实及其解释或结论都正确的是( )
| A. | 测定同温度下相同浓度的Na2CO3和Na2SO3溶液的pH,前者大于后者,说明碳元素非金属性弱于硫元素 | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 往苯酚的浊液中加入Na2CO3溶液,溶液变澄清,说明酸性:苯酚>HCO3- | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |

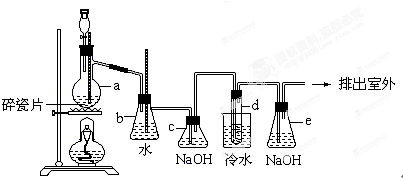
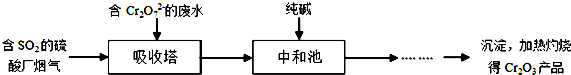
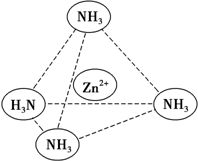 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.