题目内容
7.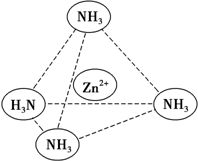 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.(1)指出锌在周期表中的位置:第四周期第IIB族,属于ds区.
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式1s22s22p63s23p63d10或[Ar]3d10;葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有sp2、sp3.
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子中心原子的 杂化方式是sp3,属于极性分子(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中用箭头表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.
分析 (1)Zn的原子序数是30,在第四周期,ⅡB 族,周期表分为s区、p区、d区、ds区、f区,根据锌的外围电子排布式分析;
(2)根据锌的基态原子电子排布式判断离子的电子排布式;葡萄糖中C有sp2、sp3两种杂化方式;
(3)N原子价层电子对个数=σ键个数+孤电子对个数,据此分析解答;不同非金属元素之间易形成极性键,正负电荷重心不重合的分子为极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键.
解答 解:(1)Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期,第ⅡB族,Zn的外围电子排布式为3d104s2,属于ds区,
故答案为:四;ⅡB;ds;
(2)Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),
故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
(3)NH3分子中心N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,分子的立体构型为三角锥形,正负电荷重心不重合的分子为极性分子,从整个分子来看,NH3分子电荷的分布是不均匀的,不对称的,是极性分子,[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,图示为: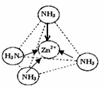 ,
,
故答案为:sp3;极性分子; .
.
点评 本题考查元素位置、核外电子排布式的书写、杂化方式的判断晶体类型的判断等知识点,题目难度中等,杂化类型的判断、核外电子排布式的书写是高考热点,是学习重点.

| A. | 1-氯丁烷 | B. | 氯乙烷 | C. | 2-氯丁烷 | D. | 溴丙烷 |
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 无色透明的水溶液中:Mg2+、H+、Cl-、SO42- |
| A. | 道尔顿 | B. | 卢瑟福 | C. | 汤姆生 | D. | 玻尔 |
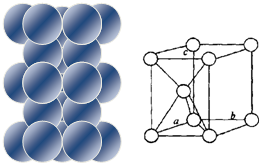 | (1)镁原子在二维空间的配位数为6 (2)位于晶胞中部的镁原子与离它最近两平面相切(填“相离”或“相切”或”相交”) |
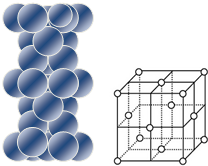 | (3)铜原子在三维空间的配位数为12 (4)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}•{{R}_{2}}^{3}}$g/cm3(根号带在分子上) |
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
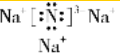 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).