题目内容
10.下列分子中所有原子都满足最外层为8电子结构的是( )| A. | NH3 | B. | PCl3 | C. | PCl5 | D. | BCl3 |
分析 对于ABn型共价化合物元素化合价绝对值(或共用电子对数)+元素原子的最外层电子层=8,则该元素原子满足8电子结构,含H元素的化合物一定不满足8电子结构.
解答 解:A.NH3中的H原子核外只有2个电子,不满足8个电子的稳定结构,故A错误;
B.PC13中P原子与3个Cl原子形成3对共用电子对,都满足8个电子的稳定结构,故B正确;
C.PCl5中P原子与5个Cl原子形成3对共用电子对,不能满足8个电子的稳定结构,故C错误;
D.BCl3中的B原子与Cl原子形成3对共用电子对,最外层只有6个电子,不满足8个电子的稳定结构,故D错误.
故选:B.
点评 本题考查分子中原子最外层电子数目的确定的知识,难度不大,理解共价化合物中元素原子满足8电子结构时:化合价绝对值+元素原子的最外层电子层=8.

练习册系列答案
相关题目
20.下表是现行的元素周期表,请按题中要求回答下列有关问题:
(1)115号元素X的位置第七周期第ⅤA族
(2)画出⑨的简单离子的结构示意图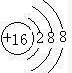 .
.
(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为 .
.
(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为 .
.
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
(2)画出⑨的简单离子的结构示意图
 .
.(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为
 .
.(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为
 .
.
1.高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160KJ/mol,而N≡N的键能为942KJ/mol.则下列说法不正确的是( )
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 无色透明的水溶液中:Mg2+、H+、Cl-、SO42- |
5.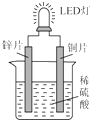 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
 如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )
如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图.下列有关该装置的说法正确的是( )| A. | 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生 | |
| B. | 如果将锌片换成铁片,电路中的电流方向将改变 | |
| C. | 其能量转化的形式主要是“化学能→电能→光能” | |
| D. | 如果将稀硫酸换成柠檬汁,LED灯将不会发光 |
2.下列哪位科学家根据a粒子散射实验提出了原子结构的有核模型( )
| A. | 道尔顿 | B. | 卢瑟福 | C. | 汤姆生 | D. | 玻尔 |
20.下列实验方法或装置正确的是( )
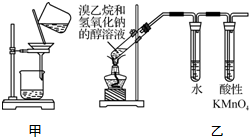

| A. | 用玻璃棒蘸取氯水点在干燥的pH试纸上,测定该溶液的pH | |
| B. | 称取4.0 g NaOH,放入100 mL容量瓶中,加水稀释,配制1.0 mol•L-1的NaOH溶液 | |
| C. | 用甲装置分离Cl2与KI溶液反应生成的碘 | |
| D. | 用乙装置检验溴乙烷与NaOH醇溶液共热产生乙烯 |
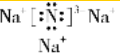 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).