题目内容
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1 mol丙烯醛中含有双键的数目为0.1 NA | |
| C. | 标准状况下,2.24 L乙醇中含有分子的数目为0.1NA | |
| D. | 0.1 mol的氯气全部溶于水后转移电子的数目为0.1NA |
分析 A.白磷和红磷分子均由磷原子构成;
B.丙烯醛中含碳碳双键、碳氧双键,共2条双键;
C.气体摩尔体积使用对象为气体;
D.氯气与水的反应中,只有部分氯气与水反应生成氯化氢和次氯酸;
解答 解:A.白磷和红磷分子均由磷原子构成,故3.1g混合物中含有的磷原子的物质的量为n=$\frac{3.1g}{31g/mol}$=0.1mol,故含0.1NA个磷原子,故A正确;
B.丙烯醛中含碳碳双键、碳氧双键,共2条双键,故0.1mol丙烯醛中含0.2mol双键即0.2NA个,故B错误;
C.标况下,乙醇为液体,不能使用气体摩尔体积,故C错误;
D.0.1mol氯气与水的反应中,只有少量氯气与水反应生成氯化氢和次氯酸,所以反应转移的电子小于0.1mol,转移电子的数目小于0.1NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意氯气在反应中表现的性质、气体摩尔体积使用条件和对象,题目难度中等.

练习册系列答案
相关题目
16.下列不属于同种物质的是( )
| A. |  和 和 | B. |  和 和 | ||
| C. |  和CH2═CH-CH2Cl 和CH2═CH-CH2Cl | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
17.下列卤代烃发生消去后,可以得到两种烯烃( )
| A. | 1-氯丁烷 | B. | 氯乙烷 | C. | 2-氯丁烷 | D. | 溴丙烷 |
14.下列实验结论正确的是( )
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
1.高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160KJ/mol,而N≡N的键能为942KJ/mol.则下列说法不正确的是( )
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |
11.化学与社会、生活密切相关.对下现象与事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 无色透明的水溶液中:Mg2+、H+、Cl-、SO42- |
16.下面的排序正确的是( )
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
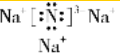 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).