题目内容
12.在25℃时,若100体积的某强酸以溶液与1体积的某强碱溶液混合后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是的强酸的pH值与强碱的pH值之和等于16.分析 先设出强酸、强碱的pH值,利用酸碱混合后溶液显中性,则n(H+)=n(OH-),然后可依据物质的量的关系来列式寻找pH的关系.
解答 解:设强酸的pH=a,强碱的pH=b,
由25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,
即n(H+)=n(OH-),
则100×10-a=1×10b-14,102-a=10b-14,即2-a=b-14,则a+b=16,
故pH(酸)+pH(碱)=16,即:强酸的pH值与强碱的pH值之和等于16,
故答案为:强酸的pH值与强碱的pH值之和等于16.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的表达式及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.25℃,下列溶液的酸性最强的是( )
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
7.碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”.下列关于DMC的说法中正确的是( )
| A. | DMC的结构简式为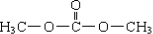 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
17.下列各组元素的性质递变情况错误的是( )
| A. | N、O、F原子最外层电子数依次增加 | B. | P、S、Cl原子半径依次减小 | ||
| C. | Na、Mg、Al元素第一电离能依次升高 | D. | Li、Na、K的金属性依次增强 |
1.同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中,正确的是( )
| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
1.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
| A. | 2H++2e-=H2↑ | B. | Fe=Fe2++2e- | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH-=2H2O+O2↑+4e- |
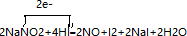 .
.