题目内容
17.下列各组元素的性质递变情况错误的是( )| A. | N、O、F原子最外层电子数依次增加 | B. | P、S、Cl原子半径依次减小 | ||
| C. | Na、Mg、Al元素第一电离能依次升高 | D. | Li、Na、K的金属性依次增强 |
分析 A.除稀有气体外,同一周期中,原子序数越大,最外层电子数逐渐增大;
B.同一周期的元素(除了稀有气体),随着原子序数的递增,原子半径逐渐减小;
C.同一周期中原子序数越大,金属性越弱,第一电离能越大;
D.同一主族中,原子序数越大,金属性越强.
解答 解:A.N、O、F位于同一周期,原子序数逐渐增大,最外层电子数逐渐增多,故A正确;
B.P、S、Cl位于第三周期,其原子序数依次增大,原子半径逐渐减小,故B正确;
C.Na、Mg、Al都位于第三周期,其原子序数逐渐增大,金属性逐渐减弱,第一电离能逐渐增大,故C错误;
D.Li、Na、K位于同一主族,其原子序数逐渐增大,金属性逐渐增强,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
8.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
5.下列反应中,一定有白色沉淀生成的是( )
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;
②向Na2CO3溶液中加入酸性CaCl2溶液;
③向Na2SO3溶液中通入Cl2,再滴加BaCl2和稀盐酸;
④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;
②向Na2CO3溶液中加入酸性CaCl2溶液;
③向Na2SO3溶液中通入Cl2,再滴加BaCl2和稀盐酸;
④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
| A. | ①②④ | B. | ①②③ | C. | ①③④ | D. | ②③④ |
2.下列反应过程中的能量变化情况符合图的是( )


| A. | Ba(OH)2•8H2O与NH4C1反应 | B. | 氢气在氯气中燃烧 | ||
| C. | 镁和盐酸的反应 | D. | 钠和水反应 |
9.下列说法中正确的是( )
| A. | 在常温常压下,“氢化油”呈液态 | |
| B. | 纤维素和淀粉均属于“糖类,它们在人体内水解的最终产物均为葡萄糖 | |
| C. | 要鉴别石蜡油中是否混有少量苯,可加入四氯化碳,萃取,观察是否分层 | |
| D. | 用灼烧闻气味的方法来区别棉织物和毛织物 |
6.实验室区别乙烷和乙烯不可采用的方法是( )
| A. | 分别通入酸性KMnO4溶液中 | B. | 分别点燃观察火焰 | ||
| C. | 分别通入澄清石灰水中 | D. | 分别通入溴水中 |
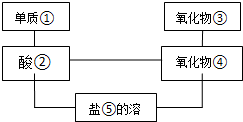 给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.
给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.