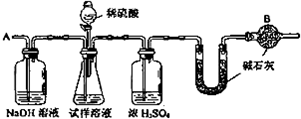
题目内容
7.碳酸二甲酯(简称DMC)是一种新化工原料,2008年在欧洲被誉为“非毒性化学品”.下列关于DMC的说法中正确的是( )| A. | DMC的结构简式为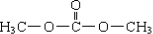 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
分析 碳酸二甲酯的结构简式为 ,为碳酸与甲醇酯化反应产物,含有酯基,具有酯的性质,以此解答该题.
,为碳酸与甲醇酯化反应产物,含有酯基,具有酯的性质,以此解答该题.
解答 解:A.DMC的结构简式为 ,故A正确;
,故A正确;
B.含有C、H、O元素,则在空气中能燃烧,产物为CO2和H2O,故B错误;
C.含有酯基,具有酯的性质,则不易溶于水,易溶于乙醇、乙醚、丙酮,故C错误;
D.由题意可知,用于生产非毒性化工产品,为绿色化工原料,对人体无害,故D正确.
故选AD.
点评 本题多角度考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点和性质,题目有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16. 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
18.下列物质属纯净物的是( )
| A. | 氨水 | B. | 王水 | C. | 含有白磷的红磷 | D. | 液氨 |
2.下列电离方程式中,书写正确的是( )
| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |
19.下列化学用语表述正确的是( )
| A. | HC1的电子式: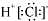 | B. | 乙烯分子的结构简式:CH2CH2 | ||
| C. | S2-的原子结构示意图: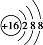 | D. | H2O2的电子式: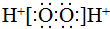 |
16.氮元素是植物生长所需的重要元素.将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
16.铀($\stackrel{235}{92}$U)已经成为新能源的主角.下列有关说法错误的是( )
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |