题目内容
2.以下为中学化学中常见的几种物质:①Cu;②NaCl溶液;③NaHSO4;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧Ba(OH)2 ⑨BaSO4(1)以上物质中属于非电解质的是④⑥;属于强电解质的是③⑤⑦⑧.
(2)⑤和⑧的水溶液反应的离子方程式SO42-+2H++2OH-+Ba2+=BaSO4↓+2H2O.
(3)NaNO3是一种无机盐,它像食盐一样咸味.已知NaNO3能发生如下反应:2NaNO3+4HI═2NO↑+I2+2NaI+2H2O.上述反应中氧化剂是NaNO2.若有0.75mol的还原剂被氧化,则被还原的氧化剂的物质的量是0.75,用单线桥法表示该反应
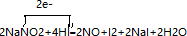 .
.
分析 (1)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质,在熔融状态和水溶液中都不能导电的化合物;
溶液中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;
(2)⑤和⑧的水溶液反应生成硫酸钡沉淀和水;
(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,根据化合价的变化分析.
解答 解:①Cu是金属单质,能导电,既不是电解质也不是非电解质,
②NaCl溶液是电解质溶液,属于混合物,
③NaHSO4是酸式盐,能完全电离出氢离子和钠离子、硫酸根离子,是强电解质,
④CO2不能导电,属于非电解质,
⑤H2SO4 溶于水能导电,能完全电离出氢离子和硫酸根离子,属于强电解质,
⑥酒精不能导电,属于非电解质,
⑦CaCO3 为难溶性盐,熔融状态下能完全电离,是强电解质,
⑧Ba(OH)2 为易溶于水的碱,水溶液中能完全导电,是强电解质,
以上物质中属于非电解质的是④⑥,属于强电解质的是③⑤⑦⑧,
故答案为:④⑥;③⑤⑦⑧;
(2)⑤和⑧的水溶液反应是硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,反应的离子方程式为:SO42-+2H++2OH-+Ba2+=BaSO4↓+2H2O,
故答案为:SO42-+2H++2OH-+Ba2+=BaSO4↓+2H2O;
(3)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,则NaNO2为氧化剂,氧化剂与还原剂的物质的量之比为1:1,有0.75mol的还原剂被氧化,则被还原的氧化剂有0.75mol,反应中氮元素化合价+3价变化为+2价,电子转移总数为2e-,用单线桥法表示该反应的化学方程式为: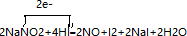
故答案为:NaNO2;0.75;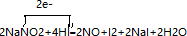 .
.
点评 本题考查了电解质和非电解质概念的理解应用、离子方程式书写、氧化还原反应电子守恒计算和概念的判断,掌握基础是解题关键,题目难度中等.

| A. | 用Na2O2作潜水器的供氧剂 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 锅炉水垢中的CaSO4可用Na2CO3溶液浸泡后再用酸清洗 | |
| D. | 工业制取粗硅是高温下用C还原SiO2 |
 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | Y元素的两种同素异形体在常温下都是气体 | |
| B. | 原子半径由大到小排列顺序Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
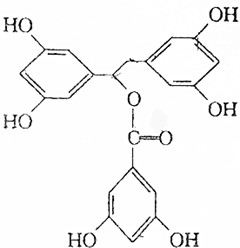 某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )
某有机物K的结构简式如图:等物质的量的K分别与足量的氢氧化钠溶液、足量氢气(镍、加热)、足量的溴水反应,消耗NaOH、H2、Br2的物质的量之比为( )| A. | 7:9:9 | B. | 8:9:9 | C. | 7:10:9 | D. | 7:9:6 |
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
| A. | 0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 常温下,pH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等 | |
| C. | 常温下将浓度为0.1 mol•L-1的HF溶液加水不断稀释,溶液中$\frac{c({H}^{+})}{c(HF)}$的值始终保持增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).