题目内容
3.经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.(1)通过计算,写出该有机物的分子式.
(2)如果该有机物遇三氯化铁溶液变为紫色,写出满足要求的所有有机物的结构简式.
分析 (1)由氧元素质量分数与氧原子数目计算有机物的相对分子质量,再结合C、H元素质量分数计算分子中C、H原子数目,进而确定有机物的分子式;
(2)如果该有机物遇FeCl3溶液会变紫色,含有酚羟基,结合有机物的分子式书写可能的结构简式.
解答 解:(1)某芳香族化合物经分析含有C、H、O的质量分数为77.7%、7.4%、14.8%,该有机物一个分子只含1个氧原子,则有机物的相对分子质量=$\frac{16}{14.8%}$=108,分子中C原子数目=$\frac{108×77.8%}{12}$=7、H原子数目=$\frac{108-12×7-16}{1}$=8,则该化合物的分子式为C7H8O,
答:该有机物的分子式为C7H8O;
(2)如果该有机物遇FeCl3溶液会变紫色,含有酚羟基,还含有一个甲基,可能的结构简式有: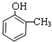 、
、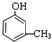 、
、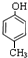 ,
,
答:满足条件的该有机物结构简式为 、
、 、
、 .
.
点评 本题考查有机物分子式确定、限制条件同分异构体书写等,侧重于学生的分析、计算能力的考查,难度中等,注意理解掌握化学式的有关计算.

练习册系列答案
相关题目
12. 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | Y元素的两种同素异形体在常温下都是气体 | |
| B. | 原子半径由大到小排列顺序Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
14.下列叙述正确的是( )
| A. | 0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 常温下,pH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等 | |
| C. | 常温下将浓度为0.1 mol•L-1的HF溶液加水不断稀释,溶液中$\frac{c({H}^{+})}{c(HF)}$的值始终保持增大 | |
| D. | 常温下0.1 mol•L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
11.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
(1)X的电负性比Y的小(填“大”或“小”).
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
18.下列物质属纯净物的是( )
| A. | 氨水 | B. | 王水 | C. | 含有白磷的红磷 | D. | 液氨 |
8.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
13.已知反应A+B?C+D的能量变化如图所示,下列说法正确的是( )


| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
