题目内容
1.同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中,正确的是( )| A. | 阴离子的还原性:Z>Y>X | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:X<Y<Z | D. | 原子原子半径:X>Y>Z |
分析 同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则原子序数:X>Y>Z,非金属性:X>Y>Z,原子半径:X<Y<Z,结合元素周期律知识解答.
解答 解:同周期的X、Y、Z三种元素,已知其最高价氧化物相应水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则原子序数:X>Y>Z,非金属性:X>Y>Z,
A.非金属性越强,对应离子的还原性越弱,非金属性:X>Y>Z,则阴离子的还原性:Z>Y>X,故A正确;
B.根据分析可知,单质的非金属性:X>Y>Z,故B正确;
C.非金属性越强,对应氢化物的稳定性越强,元素的非金属性:X>Y>Z,则氢化物的稳定性:X>Y>Z,故C错误;
D.同一周期的元素中,原子序数越大,原子半径越小,则原子半径:X<Y<Z,故D错误;
故选AB.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律之间的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
11.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
(1)X的电负性比Y的小(填“大”或“小”).
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
9.下列说法中正确的是( )
| A. | 在常温常压下,“氢化油”呈液态 | |
| B. | 纤维素和淀粉均属于“糖类,它们在人体内水解的最终产物均为葡萄糖 | |
| C. | 要鉴别石蜡油中是否混有少量苯,可加入四氯化碳,萃取,观察是否分层 | |
| D. | 用灼烧闻气味的方法来区别棉织物和毛织物 |
16.氮元素是植物生长所需的重要元素.将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
6.实验室区别乙烷和乙烯不可采用的方法是( )
| A. | 分别通入酸性KMnO4溶液中 | B. | 分别点燃观察火焰 | ||
| C. | 分别通入澄清石灰水中 | D. | 分别通入溴水中 |
13.已知反应A+B?C+D的能量变化如图所示,下列说法正确的是( )
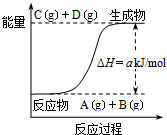

| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
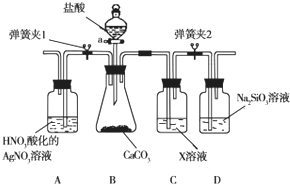 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).