题目内容
5.生活中碰到的某些问题常常涉及到化学知识,下列分析正确的是( )| A. | 碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 1mol葡萄糖能水解成2mol乙醇和2mol二氧化碳 |
分析 A.碳酸氢钠与NaOH、盐酸均反应;
B.苹果为碱性食物;
C.光导纤维的成分为二氧化硅;
D.葡萄糖发生酒化反应生成乙醇和二氧化碳.
解答 解:A.碳酸氢钠与NaOH、盐酸均反应,则碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂,故A正确;
B.苹果为碱性食物,则胃酸过多的人不宜鸡肉等酸性食物,故B错误;
C.光导纤维的成分为二氧化硅,为无机材料,而人造纤维、合成纤维都是有机高分子化合物,故C错误;
D.葡萄糖发生酒化反应生成乙醇和二氧化碳,而葡萄糖不能水解,故D错误;
故选A.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、发生的反应及应用为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
15.X、Y、Z、W、M五种短周期元素的原子序数依次增大,X原子的电子层数等于其电子总数.Z原子最外层电子数与x、Y原子最外层电子数之和相等,W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍,W原子的最外层电子数为电子层数的3倍,X、M同主族,下列说法正确的是( )
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
16.下列说法不正确的是( )
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 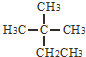 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(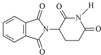 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
17.下列物质一定属于同系物的是( )
①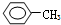
②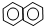
③
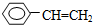
④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦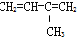
⑧
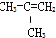
①

②
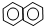
③
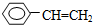
④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦
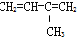
⑧
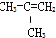
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
14.已知A、B、C、D、E是短周期中原子序数一次增大5种主族元素,其中元素A、E的单 质常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | D单质能够溶解于C的最高价氧化物对应的水化物 |
15.X、Y、Z、W是原子序数依次增大的短周期元素,X最高正价与最低负价的代数和为零,Y、Z易形成质量比为3:4和3:8的两种常见化合物,含W元素的物质其焰色反应为黄色.下列说法正确的是( )
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |

 .
.