题目内容
10.已知丙醛的燃烧热为1815KJ/mol,丙酮的燃烧热为1789KJ/mol,试写出丙醛燃烧热的热化学方程式CH3CH2CHO(l)+4O2(g)═3CO2(g)+3H2O(l)△H=-1815kJ/mol.分析 结合燃烧热及热化学方程式原则进行书写,注明物质的聚集状态、反应热数值.
解答 解:丙醛的燃烧热为1815kJ/mol,则丙醛燃烧的热化学方程式为CH3CH2CHO(l)+4O2(g)═3CO2(g)+3H2O(l)△H=-1815kJ/mol,
故答案为:CH3CH2CHO(l)+4O2(g)═3CO2(g)+3H2O(l)△H=-1815kJ/mol.
点评 本题考查了燃烧热热化学方程式的书写方法,要求标注状态,定量书写,此题为易错点,难度不大.

练习册系列答案
相关题目
20.2015年国际十大环境新闻之一是“《巴黎协定》”;降低碳排放,明确全球升温控制在2℃内的目标,下列有关二氧化碳的说法不正确的是( )
| A. | 二氧化碳是一种弱电解质 | |
| B. | 金属钠着火不能用液态二氧化碳灭火 | |
| C. | 二氧化碳和水经“人工树叶”合成燃油,可实现由太阳能转变为化学能 | |
| D. | 用二氧化碳合成可降解的聚碳酸酯塑料,有利于遏制白色污染 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
18.如图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( )


| A. | 可以选用方案Ⅰ分离NaCl中的I2 | |
| B. | 方案Ⅰ中X物质不可能是受热易分解的物质 | |
| C. | 方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3 | |
| D. | 方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂 |
5.生活中碰到的某些问题常常涉及到化学知识,下列分析正确的是( )
| A. | 碳酸氢钠可用于制备纯碱、治疗胃酸过多的药剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 1mol葡萄糖能水解成2mol乙醇和2mol二氧化碳 |
15.关于电化学内容,下列说法正确的是( )
| A. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
2.不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.下列有关说法不正确的是( )
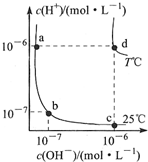

| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
20. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
通过计算得出△H=-2208kJ/mol.
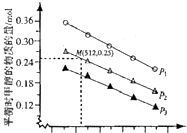
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
(1)海水经初步处理后,还含有Ca2+、Mg2+,Na+、CL-,向其中加入石灰浆使海水中的Mg2+转换 为Mg(OH)2,当Mg2+刚好沉淀完全时,c( Ca2+)为4.58mol/L
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
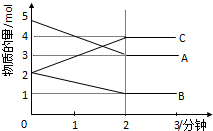 某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则:
某可逆反应在体积为2升的密闭容器中进行反应(A、B、C均为气体),在不同反应时间各物质的量的变化情况如图所示.则: