题目内容
11.下列离子方程式正确的是( )| A. | 稀硝酸与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
分析 A.二者反应实质氢离子与氢氧根离子反应生成水;
B.电荷不守恒;
C.氯化铁为可溶性盐,应拆成离子形式;
D.二氧化碳与澄清石灰水反应生成碳酸钙和水.
解答 解:A.稀硝酸与氢氧化钠溶液反应,离子方程式:H++OH-=H2O,故A正确;
B.铝与稀盐酸反应,离子方程式:2Al+2H+=2Al3++3H2↑,故B错误;
C.三氯化铁溶液与氢氧化钠溶液反应,离子方程式:Fe3++3OH-=Fe(OH)3↓,故C错误;
D.二氧化碳与澄清石灰水反应,离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O,故D错误;
故选:A.
点评 本题考查了离子方程式书写正误判断,明确离子方程式书写方法是解题关键,注意化学式的拆分,注意离子反应遵循客观事实、遵循电荷守恒规律,题目难度不大.

练习册系列答案
相关题目
1.化学与科学研究、工农业生产、环境保护、日常生活等方面有广泛联系.下列有关说法中正确的是( )
| A. | 石灰石可用于炼铁、制水泥、制玻璃 | |
| B. | 使用苯代替酒精擦拭手机屏幕 | |
| C. | 同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一 | |
| D. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心 |
2.已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
19.下列说法不正确的是( )
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
16.下列各组物质所含化学键类型完全相同的是( )
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
3.下列各组中的两种物质作用时,反应条件或反应物用量改变时,对生成物没有影响的是( )
| A. | Na2O2与CO2 | B. | Na与O2 | C. | NaOH与CO2 | D. | NaAlO2与HNO3 |
20.具有顺反异构体的物质是( )
| A. |  | B. |  | ||
| C. |  | D. | H2C═CH2 |
11. 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
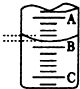
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显少于后两次,其原因可能是AE
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.
 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.