题目内容
19.下列说法不正确的是( )| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 乙烯使高锰酸钾褪色和二氧化硫使溴水褪色的原理不相同 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
分析 A、通常我们把物质的状态分为固态、液态和气态,但是某些有机化合物具有一种特殊的状态,在这种状态中,他们一方面像液体,具有流动性,一方面又像晶体,分子在某个方向上排列比较整齐,因而具有各向异性,这种物质叫液晶,据此解答即可;
B、冰中存在氢键,具有方向性和饱和性,其体积变大;
C、乙烯使高锰酸钾褪色和二氧化硫使溴水褪色都是发生氧化还原反应而褪色;
D、二氧化硫、二氧化氮是形成酸雨的主要物质;为减少酸雨的产生,只要减少二氧化硫、氮氧化物就可以防止酸雨的产生.
解答 解:A.液晶态是指介于晶体和液体之间的物质状态,像液体具有流动性,像固体具有晶体的有序性,故A正确;
B.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故B正确;
C、乙烯使高锰酸钾褪色和二氧化硫使溴水褪色都是发生氧化还原反应而褪色,所以原理相同,故C错误;
D、采用燃料脱硫技术可以减少二氧化硫的产生,从而防止出现酸雨,NOx的催化转化生成无污染的氮气也是减少酸雨的有效措施,故D正确.
故选C.
点评 本题主要考查的是液晶的概念以及其性质、氢键的作用、乙烯的性质、燃料脱硫等,综合性较强,难度一般.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L己烷中共价键数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数为2NA | |
| D. | 足量Fe与标准状况下22.4 L Cl2充分反应,转移的电子数为2NA |
10.消除氮氧化物和硫氧化物有助于预防雾霾天气的形成.
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
①0~10min内,NO的平均反应速率v(NO)=0.06mol/(L•min),该温度下反应的平衡常数K=0.5625.
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.
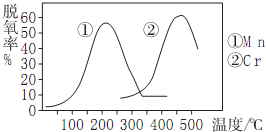
②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.

②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
14.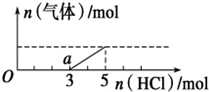 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | a点溶液中c (HCO3-)>c (CO32-) | |
| C. | 标准状况下,通入CO2的体积为44.8L | |
| D. | 原NaOH溶液的物质的量浓度为5mol/L |
11.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
8.下列分子为直线形分子且分子中所有原子都满足最外层8电子稳定结构的是( )
| A. | BeCl2 | B. | C2H2 | C. | CO2 | D. | NH3 |
9.下列物质的转化在给定条件下能实现的是( )
| A. | SiO2$\stackrel{HCl}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | MgCO3$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| C. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| D. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 |