题目内容
2.已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
分析 X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,结合元素周期律来解答.
解答 解:X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A.非金属性X>Y>Z,则气态氢化物的稳定性:HX>H2Y>ZH3,故A正确;
B.由上述分析可知,非金属性X>Y>Z,故B错误;
C.同周期非金属性强的原子半径小,则原子半径:Z>Y>X,故C错误;
D.同周期从左向右最外层电子数增大,则原子最外层电子数:X>Y>Z,故D错误;
故选A.
点评 本题考查位置、结构与性质的应用,为高频考点,把握同周期元素的性质为解答的关键,侧重分析与应用能力的考查,注意周期律及元素的性质,题目难度不大.

练习册系列答案
相关题目
12. 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
分析上述数据,回答下列问题:
(1)实验1中电流由B极流向A极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是铝电极(填“镁”或“铝”)
(3)实验3 表明B
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是A
A.相对活泼的金属一旦做负极
B.失去电子的电极是负极
C.烧杯中的溶液,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行试验并得到下表实验结果:| 序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Cu | 乙醇 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
(1)实验1中电流由B极流向A极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是铝电极(填“镁”或“铝”)
(3)实验3 表明B
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是A
A.相对活泼的金属一旦做负极
B.失去电子的电极是负极
C.烧杯中的溶液,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
10.消除氮氧化物和硫氧化物有助于预防雾霾天气的形成.
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
①0~10min内,NO的平均反应速率v(NO)=0.06mol/(L•min),该温度下反应的平衡常数K=0.5625.
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.
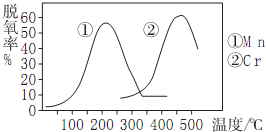
②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.

②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
14.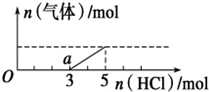 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | a点溶液中c (HCO3-)>c (CO32-) | |
| C. | 标准状况下,通入CO2的体积为44.8L | |
| D. | 原NaOH溶液的物质的量浓度为5mol/L |
11.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钠溶液反应:H++OH-=H2O | |
| B. | 铝与稀盐酸反应:Al+2H+=Al3++H2↑ | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与澄清石灰水反应:CO2+2OH-=CO32-+H2O |
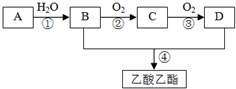 A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;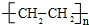 .
.