题目内容
8.0.1mol/L的Na2CO3溶液中,下列关系正确的是( )| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
分析 碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,但其水解程度较小,溶液中存在电荷守恒及物料守恒,根据电荷守恒及物料守恒判断.
解答 解:A.碳酸根离子第一步水解程度远远大于第二步水解程度,所以溶液中c(HCO3-)>c(H2CO3),故A正确;
B.溶液中存在质子守恒c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),则不存在c(OH-)=2c(H+),故B错误;
C.碳酸根离子电解导致碳酸根离子浓度小于0.1mol/L,钠离子浓度为0.2mol/L,所以c(Na+)>2c(CO32-),故C错误;
D.溶液中存在物料守恒c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],则c(Na+)>c(CO32-)+c(HCO3-),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确盐类水解原理是解本题关键,注意溶液中存在的物料守恒及质子守恒,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
18.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
回答下列问题:
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol
c.大于0.5mol,小于1.0mol d.无法确定.
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol
c.大于0.5mol,小于1.0mol d.无法确定.
3.下列无色溶液中可以能大量共存的离子组是( )
| A. | Na+、NO3-、Cl- | B. | Cu2+、K+、NO3- | C. | H+、HCO3-、NO3- | D. | Na+、Ba2+、SO42- |

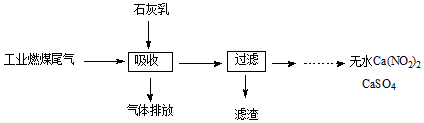
 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验
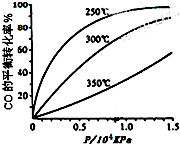 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.