题目内容
10.有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)?N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)40min后的反应速率一定(填“一定”或“不一定”)比20~30min内的反应速率快.
分析 (1)分析图表数据结合化学反应速率概念计算v=$\frac{△c}{△t}$;
(2)反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
(3)根据浓度大反应速率大判断.
解答 解:(1)分析图表数据,10~20min内,N2的平均反应速率v(N2)=$\frac{△c}{△t}$=$\frac{0.25mol/L-0.16mol/L}{10min}$=0.009 mol/(L•min),故答案为:0.009 mol/(L•min);
(2)30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
A.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故A符合;
B.加入一定量的活性炭是固体,对平衡无影响,故B不符合;
C.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故C不符合;
D.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故D符合;
故答案为:AD;
(3)分析图表数据,40min时的浓度比20~30min内的浓度大,所以40min后的反应速率一定比20~30min内的反应速率快,故答案为:一定.
点评 本题考查了化学平衡常数和反应速率概念计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.在1LK2SO4和CuSO4的混合溶液中,C(SO42-)=2mol•L-1,用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
18.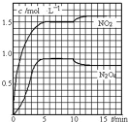 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
5.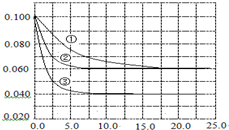 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应A+2B?C的△H>0 | |
| B. | 若反应①、②的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 实验②平衡时B的转化率为60% | |
| D. | 减小反应③的压强,可以使平衡时c(A)=0.060 mol•L-1 |
15.在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应( )
CO(g)+2H2(g)?CH3OH(g) 实验测得T1℃和 T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CO(g)+2H2(g)?CH3OH(g) 实验测得T1℃和 T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
| 温度 时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| T1℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
| T2℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
| A. | 由上述数据可以判断:T1℃>T2℃ | |
| B. | 该反应的焓变△H>0,升高温度K增大. | |
| C. | T1℃时,0~20 min H2的平均反应速率 ν(H2)=0.003mol/(L•min) | |
| D. | T2℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算出反应达平衡后甲醇的浓度 |
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH${\;}_{4}^{+}$+OH-,如果增大NH${\;}_{4}^{+}$的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |