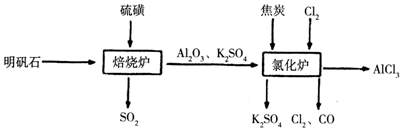
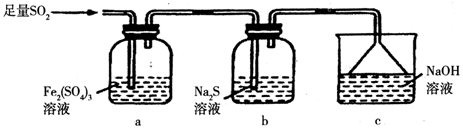
题目内容
15.在1LK2SO4和CuSO4的混合溶液中,C(SO42-)=2mol•L-1,用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,则阴极放出氢气也为1mol,
阳极发生电极反应为:4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑
1mol 2mol 1mol 2mol 2mol 1mol
c(Cu2+)=$\frac{1mol}{1L}$=1mol/L,由电荷守恒可知,原混合溶液中c(K+)为2mol/L×2-1mol/L×2=2mol/L,故A正确.
故选A.
点评 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
3.化学平衡移动原理在化T生产和科学研究中具有重要的指导作用,第一个提出平衡移动原理的科学家是( )
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
20.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | H2 (g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 | |
| B. | 2H2(g)+O2 (g)═2H2O(g);△H1 2H2 (g)+O2 (g)═2H2O(l);△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g);△H1 2CO(g)+O2(g)═2CO2(g);△H2 | |
| D. | S(s)+O2(g)═SO2 (g);△H1 S(g)+O2(g)═SO2 (g);△H2 |
7.下列各组物质中,依次属于酸、盐、碱、非电解质的一组是( )
| A. | 硫酸 硫酸铜 纯碱 干冰 | B. | 硝酸 硝酸银 熟石灰 干冰 | ||
| C. | 碳酸 纯碱 食盐 冰 | D. | 醋酸 食盐 烧碱 铜 |
4.下列叙述正确的是( )
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 吸热反应和熵减的反应都具有自发进行的倾向 | |
| C. | 正、逆反应速率都改变,化学平衡一定发生移动 | |
| D. | 同温同压下,H2(g)+Cl2(g)?2HCl(g)在光照和点燃条件下的△H相同 |
10.有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)?N2(g)+CO2(g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
(1)10~20min内,N2的平均反应速率v(N2)=0.009 mol/(L•min).
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)40min后的反应速率一定(填“一定”或“不一定”)比20~30min内的反应速率快.
| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)40min后的反应速率一定(填“一定”或“不一定”)比20~30min内的反应速率快.