题目内容
2.(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g);△H=+131.28kJ•mol-1.(2)已知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ•mol-1,2H2(g)+O2(g)═2H2O(g);△H2=-Q2 kJ•mol-1,2H2(g)+O2(g)═2H2O(l);△H2=-Q3 kJ•mol-1.
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为0.4Q1+0.05Q3 kJ.
(3)已知,在101kPa时,H2与1.00mol O2完全燃烧,生成2.00mol液态水,放出571.6kJ的热量,表示氢气燃烧热的热化学反应方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1.
分析 (1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,并注意物质的状态来解答;
(2)根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量.注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算;
(3)根据燃烧热的概念计算1mol氢气完全燃烧放出的热量,再写热化学方程式.
解答 解:(1)由1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ•mol-1;故答案为:C(s)+H2O (g)═CO(g)+H2(g);△H=+131.28kJ•mol-1;
(2)甲烷和氢气的混合气体11.2L(已折合成标准状况),所以甲烷和氢气的混合气体的总的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l);△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×$\frac{1}{2}$×Q3kJ/mol=0.05Q3kJ.
所以放出的热量为0.4Q1+0.05Q3;
故答案为:0.4Q1+0.05Q3;
(3)一定量H2在O2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量,所以1mol氢气完全燃烧放出热量285.8KJ,氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2 (g)═H2O(l)△H=-285.8kJ•mol-1.
点评 本题考查热化学反应方程式的书写,明确物质的量与反应热的关系、△H的数值、单位、符号即可解答,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | 硫酸 硫酸铜 纯碱 干冰 | B. | 硝酸 硝酸银 熟石灰 干冰 | ||
| C. | 碳酸 纯碱 食盐 冰 | D. | 醋酸 食盐 烧碱 铜 |
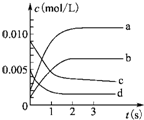 在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)40min后的反应速率一定(填“一定”或“不一定”)比20~30min内的反应速率快.
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
| A. | 当体系压强不变时反应一定达到平衡 | |
| B. | 反应放出的热量为 0.2a kJ | |
| C. | 若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 | |
| D. | 在相同条件下再加入0.2mol的CO和0.2mol的 H2O(g),重新达平衡时,c(CO):c(CO2)=3:2 |
| A. | 体积 ②>③>①>④ | B. | 密度 ②>③>④>① | ||
| C. | 质量 ②>③>④>① | D. | 氢原子个数 ①>③>④>② |
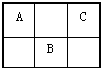 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. 、
、 .
.