题目内容
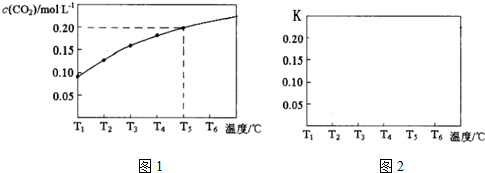
5.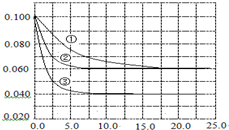 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应A+2B?C的△H>0 | |
| B. | 若反应①、②的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 实验②平衡时B的转化率为60% | |
| D. | 减小反应③的压强,可以使平衡时c(A)=0.060 mol•L-1 |
分析 在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小;
A.依据升高温度平衡向吸热方向移动判断解答;
B.平衡常数只与温度有关;
C.由图可知,实验②平衡时A的浓度为0.06mol/L,计算A的浓度变化量,再利用方程式计算B的浓度变化量,进而计算平衡时B的转化率;
D.在溶液中,压强对化学平衡无影响;
解答 解:在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小;
A.依据升高温度平衡向吸热方向移动,对比②③可知,升高温度A的浓度降低,则平衡正向移动,正向为吸热反应,△H>0,故A正确;
B.由图象分析可知①②相比,②为使用催化剂,使用催化剂不能改变反应的平衡常数,所以K1=K2,故B错误;
C.由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为$\frac{0.08mol/L}{0.2mol/L}$×100%=40%,故C错误;
D.在溶液中,压强对化学平衡无影响,改变压强平衡不移动,故D错误;
故选:A.
点评 本题考查化学平衡浓度-时间图象、化学反应速率计算、化学平衡影响因素等,明确温度、催化剂、压强对平衡移动的影响是解题关键,注意化学原理基础知识的灵活运用,难度不大.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案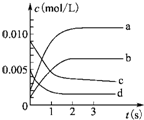 在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是D
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
| 时间/min 浓度/(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母序号).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)40min后的反应速率一定(填“一定”或“不一定”)比20~30min内的反应速率快.
SO2(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,其他条件不变,分离出硫,正反应速率加快 | |
| C. | 平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 | |
| D. | 其他条件不变,使用不同催化剂,该反应平衡常数不变 |

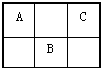 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.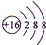 、
、 .
.