题目内容
15.写出下列反应的离子方程式,并用单线桥标明电子转移的方向和数目.①Cu和AgNO3溶液:
 .
.②实验室制Cl2的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O:
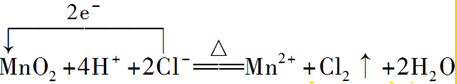 .
.③向FeCl2溶液中通入Cl2生成FeCl3:
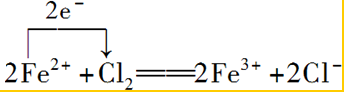 .
.
分析 ①Cu和AgNO3溶液反应生成硝酸铜和金属银的反应中,Cu元素的化合价升高,Ag元素的化合价降低,该反应中转移2e-,以此来解答;
②二氧化锰与浓盐酸反应生成氯化锰、氯气和水,反应中Mn元素的化合价降低,转移2e-,以此来解答;
③向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,以此来解答.
解答 解:①Cu和AgNO3溶液反应生成硝酸铜和金属银,离子反应为:Cu+2Ag+═Cu2++2Ag,化合价升高值=化合价降低值=转移电子数=2,电子转移表示为: ,故答案为:
,故答案为: ;
;
②实验室制Cl2的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中Mn元素的化合价降低,转移2e-,则用单线桥标明电子转移的方向和数目: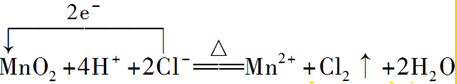 ;
;
故答案为: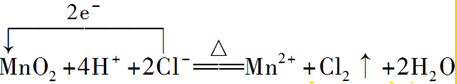 ;
;
③向FeCl2溶液中通入Cl2生成FeCl3,铁元素的化合价升高,该反应中转移2e-,则用单线桥标明电子转移的方向和数目: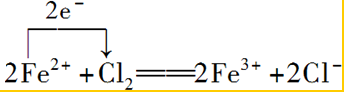 ;
;
故答案为: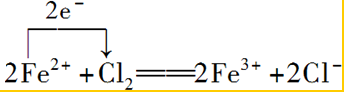 .
.
点评 本题考查学生离子方程式的书写以及氧化还原反应中的电子转移知识,属于基本知识的考查题,难度不大,注意从化合价的角度分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数据中,前者大于后者的是( )
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
6.下列叙述正确的是( )
| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
5.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O )的流程如下.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)室温下,将NaOH溶液逐滴加入到浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中,先生成的沉淀是Cu(OH)2.(室温时KSP[Mg(OH)2]=1.8×10-11,KSP[Cu(OH)2]=2.2×10-20)
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉,达到滴定终点时的溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质.
①试剂X可选用下列物质中的ad(填代号).
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)由溶液Ⅱ制备CuCl2•2H2O的操作依次为:边滴加浓盐酸边加热浓缩、冷却结晶(填操作名称)、过滤、洗涤干燥.
(3)室温下,将NaOH溶液逐滴加入到浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中,先生成的沉淀是Cu(OH)2.(室温时KSP[Mg(OH)2]=1.8×10-11,KSP[Cu(OH)2]=2.2×10-20)
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不与发生反应).实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2CuI+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴指示剂,用c mol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉,达到滴定终点时的溶液颜色变化为溶液由蓝色变为无色.
②该样品中CuCl2•2H2O 的质量分数为$\frac{{171cV×{{10}^{-3}}×10}}{m}×100%$(用含m、c、V的代数式表示,不用化简).
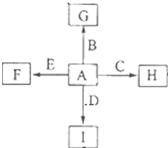 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: