题目内容
7.研究铁及其化合物对生产生活具有重要的意义.(1)已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
C(s)+O2(g)═CO2(g)△H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
(2)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:

①该反应△H>0(填“<”或“>”).
②下列措施中能使平衡时c(CO)/c(CO2)增大的是A(填序号).
A.升高温度 B.增大压强 C.充入一定量CO D.再加入一些铁粉
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示,8分钟内,CO的平均反应速率v(CO)=0.0625mol/(L•min).计算该反应的平衡常数K=2.5.
(3)铁的重要化合物高铁酸钠是一种饮用水消毒剂,具有氧化能力强、安全性好等优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑,则电解时阳极的电极反应式是Fe-6e-+8OH-=FeO42-+4H2O.
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
分析 (1)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(2)①图象甲中平衡常数曲线随温度升高增大,说明正反应为吸热反应,逆向为放热反应;
②当能使平衡时c(CO)/c(CO2)增大,则平衡正向移动;
③Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量 0.7 0
变化量 0.5 0.5
平衡量 0.2 0.5
结合速率计算及K表达式计算;
(3)①Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑,阳极上Fe失去电子;
②在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,只有钠离子实际不参加反应.
解答 解:(1)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(2)①图象甲中平衡常数曲线随温度升高而增大,说明正反应为吸热反应,△H>0,故答案为:>;
②Fe(s)+CO2(g)?FeO(s)+CO(g),反应前后是气体体积不变的吸热反应,
A.升高温度,平衡正向移动,则c(CO)/c(CO2)增大,故A正确;
B.增大压强,平衡不移动,c(CO)/c(CO2)不变,故B错误;
C.充入一定量CO,平衡时c(CO)/c(CO2)不变,故C错误;
D.再加入一些铁粉,平衡不移动,c(CO)/c(CO2)不变,故D错误;
故答案为:A;
③Fe(s)+CO2(g)?FeO(s)+CO(g),
起始量 0.7 0
变化量 0.5 0.5
平衡量 0.2 0.5
8分钟内,CO的平均反应速率v(CO)=$\frac{0.5mol/L}{8min}$=0.0625mol/(L•min),
K=$\frac{0.5}{0.2}$=2.5,
故答案为:0.0625mol/(L•min);2.5;
(3)①Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑,阳极上Fe失去电子,阳极反应为Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
②在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,离子反应为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查较综合,涉及化学平衡常数及计算、电解原理应用等,为高考常见题型,把握物质的性质及反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液的导电性逐渐增大 | |
| D. | 将0.2 mol•L-1 KHCO3溶液与0.1 mol•L-1 KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) |
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
| A. | CO2气体通入Na2SiO3溶液中 | B. | CO2气体通入饱和Na2CO3溶液中 | ||
| C. | SO2气体通入BaCl2溶液中 | D. | SO2气体通入Ba(OH)2溶液中 |
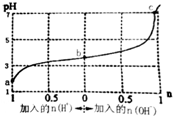
| A. | b点溶液中c(A-)>c(Na+)>c(HA) | |
| B. | 通入HCl后,c(HA)/c(A-)增大 | |
| C. | 当加入1 mol NaOH后,溶液中c(Na+)=c(A-) | |
| D. | a、b、c三点溶液中水的电离程度依次增大 |
 .
.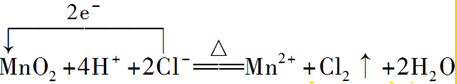 .
.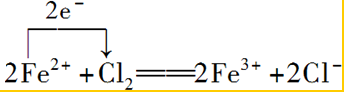 .
.
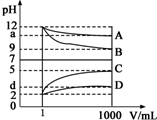 物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题:
物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题: