题目内容
3.利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如图.已知NO和NO2按1:1通入碱液中生成亚硝酸盐.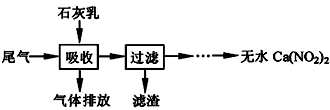
(1)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是使尾气中的NO、NO2被充分吸收;滤渣可循环使用,滤渣的主要成分是Ca(OH)2(填化学式).
(2)该工艺需控制NO 和NO2 物质的量之比接近1:1.若n(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则会导致产品Ca(NO2)2中Ca(NO3)2含量升高.
分析 (1)使尾气中NO、NO2与石灰乳充分接触;滤渣的主要成分是Ca(OH)2;
(2)若n(NO):n(NO2)>1:1,则一氧化氮过量,若<1:1,则二氧化氮过量.
解答 解:(1)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(2)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
点评 本题考查学生在“工艺流程阅读分析,化学反应原理在工艺流程的应用,氧化还原反应分析,相关反应的书写”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.

练习册系列答案
相关题目
13.与水一样,甲醇也能微弱电离:2CH3OH(l)?CH3OH2++CH3O-,25℃时,K=2.0×10-17.若甲醇中加入少量金属钠,则下列叙述不正确的是( )
| A. | 金属钠与水反应比金属钠与甲醇反应更剧烈 | |
| B. | 结合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
14.下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 硫酸、纯碱、食盐 | B. | 醋酸、烧碱、生石灰 | ||
| C. | 硝酸、烧碱、胆矾 | D. | 盐酸、熟石灰、氧化镁 |
18.25℃时,部分弱酸的电离平衡常数如表:
下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液的导电性逐渐增大 | |
| D. | 将0.2 mol•L-1 KHCO3溶液与0.1 mol•L-1 KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) |
12.下列实验一定不会出现沉淀现象的是( )
| A. | CO2气体通入Na2SiO3溶液中 | B. | CO2气体通入饱和Na2CO3溶液中 | ||
| C. | SO2气体通入BaCl2溶液中 | D. | SO2气体通入Ba(OH)2溶液中 |
13.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- | |
| B. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、HCO3-、SO42- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、AlO2- |
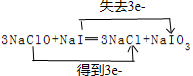 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.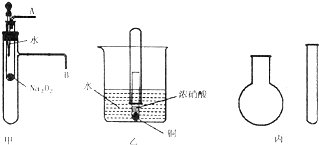 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题: .
.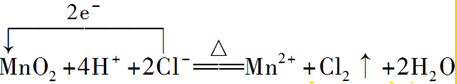 .
.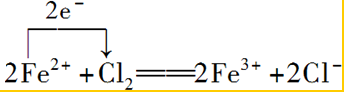 .
.