题目内容
6.下列叙述正确的是( )| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
分析 A、氢气在氯气中燃烧发出苍白色火焰,反应放出热量生成的氯化氢遇到空气中的水蒸气形成白雾;
B、SiO2的化学性质不活泼,但能与氢氟酸反应;
C、铝、铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应;
D、氯气通入紫色石蕊试液中,氯气与水反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能够使石蕊变红,次氯酸具有漂白性,能够使变红的溶液褪色.
解答 解:A、氢气在氯气中燃烧发出苍白色火焰,反应放出热量生成的氯化氢遇到空气中的水蒸气形成白雾,不发出黄色火焰,故A错误;
B、SiO2的化学性质不活泼,但能与氢氟酸反应,而不是不与任何酸发生反应,故B错误;
C、铝、铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应,发生钝化现象,故C正确;
D、氯气通入紫色石蕊试液中,氯气与水反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能够使石蕊变红,次氯酸具有漂白性,能够使变红的溶液褪色,故D错误;
故选C.
点评 本题考查了物质的用途,明确物质的性质是解本题关键,根据物质的性质分析解答即可,注意氯气的性质,题目难度不大,注意把握氯气与水的反应及氯水具有酸性和漂白性为解答的关键,题目难度不大.

练习册系列答案
相关题目
14.下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 硫酸、纯碱、食盐 | B. | 醋酸、烧碱、生石灰 | ||
| C. | 硝酸、烧碱、胆矾 | D. | 盐酸、熟石灰、氧化镁 |
1.下列有关物质制备说法不正确的是( )
| A. | 高温下焦炭还原二氧化硅制得粗硅 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 可用CO高温下还原赤铁矿炼铁 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
18.25℃时,部分弱酸的电离平衡常数如表:
下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中:c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液的导电性逐渐增大 | |
| D. | 将0.2 mol•L-1 KHCO3溶液与0.1 mol•L-1 KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) |
16.25℃时,向1L浓度均为1mol•L-1的弱酸(HA)及其盐(NaA)组成的混合溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入n(H+)或n(OH-)而变化的曲线如图.下列有关说法错误的是( )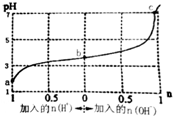

| A. | b点溶液中c(A-)>c(Na+)>c(HA) | |
| B. | 通入HCl后,c(HA)/c(A-)增大 | |
| C. | 当加入1 mol NaOH后,溶液中c(Na+)=c(A-) | |
| D. | a、b、c三点溶液中水的电离程度依次增大 |
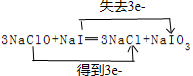 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3. .
.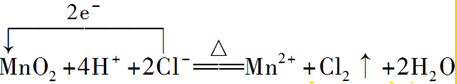 .
.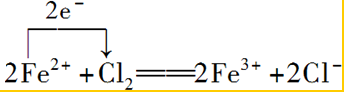 .
.