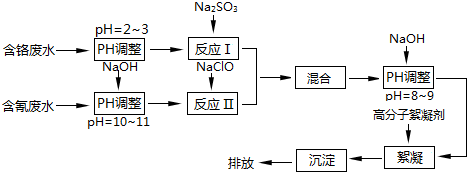
题目内容
4.Q、R、X、M、Y、Z是周期表前四周期的五种元素,原子序数依次递增.已知:①Z位于ds区,最外能层有单电子,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn,M的基态原子2p能级有1个单电子
③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.回答下列问题:
(1)基态Z2+的价电子排布式是1s22s22p63s23p63d9.
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的孤电子对形成配位键.
(3)Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是b.
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)写出由R、X两元素组成的与N3-互为等电子体的微粒(分子和离子各一种)N2O、NO2+.
(5)X、M两元素形成的化合物XM2的VSEPR模型名称为四面体形,已知XM2分子的极性比水分子的极性弱,其原因是OF2和H2O均为V形分子且中心原子孤电子对均为2对,F于O的电负性差值比O与H的电负性差值小.
分析 Q、R、X、M、Y、Z五种元素的原子序数依次递增,Z位于ds区,最外能层有单电子,Z为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素;X原子的核外电子排布为1s22s22p4,X为O元素;Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素;M的基态原子2p能级有1个单电子,核外电子排布为1s22s22p5,则M为F元素;R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,据此解答.
解答 解:Q、R、X、M、Y、Z五种元素的原子序数依次递增,Z位于ds区,最外能层有单电子,Z为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素;X原子的核外电子排布为1s22s22p4,X为O元素;Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素;M的基态原子2p能级有1个单电子,核外电子排布为1s22s22p5,则M为F元素;R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素.
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,Cu原子失去4s能级的1个电子及3d能级中的1个电子形成Cu2+,Cu2+的核外电子排布式是1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)在[Cu(NH3)4]2+离子中,Cu2+的空轨道接受NH3分子提供的孤电子对形成配位键,
故答案为:孤电子对;
(3)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,非金属性C>Si,故稳定性CH4>SiH4,二者结构相似,都可以形成分子晶体,相对分子质量越大,沸点越高,故沸点CH4<SiH4,
故答案为:b;
(4)由R、X两元素组成的与N3-互为等电子体的微粒为:N2O、NO2+,
故答案为:N2O、NO2+;
(5)X、M两元素形成的化合物OF2中O原子价层电子对数=$\frac{6-1×2}{2}$=2、价层电子对数=2+2=4,VSEPR模型名称为四面体形,已知OF2分子的极性比水分子的极性弱,其原因是:OF2和H2O均为V形分子且中心原子孤电子对均为2对,F于O的电负性差值比O与H的电负性差值小,
故答案为:四面体形;OF2和H2O均为V形分子且中心原子孤电子对均为2对,F于O的电负性差值比O与H的电负性差值小.
点评 本题考查结构与位置关系、核外电子排布规律、元素周期律、化学键、等电子体、价层电子对数理论等,推断元素是解题的关键,注意对基础知识的理解掌握.

| A. | 硫酸、纯碱、食盐 | B. | 醋酸、烧碱、生石灰 | ||
| C. | 硝酸、烧碱、胆矾 | D. | 盐酸、熟石灰、氧化镁 |
| A. | CO2气体通入Na2SiO3溶液中 | B. | CO2气体通入饱和Na2CO3溶液中 | ||
| C. | SO2气体通入BaCl2溶液中 | D. | SO2气体通入Ba(OH)2溶液中 |
| A. | Ba(OH)2═Ba2++2OH- | B. | AlCl3═Al3++Cl3- | ||
| C. | H2SO4═2H++S6++4O2- | D. | Na2CO3═Na2++CO32- |
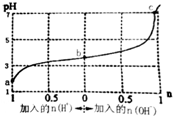
| A. | b点溶液中c(A-)>c(Na+)>c(HA) | |
| B. | 通入HCl后,c(HA)/c(A-)增大 | |
| C. | 当加入1 mol NaOH后,溶液中c(Na+)=c(A-) | |
| D. | a、b、c三点溶液中水的电离程度依次增大 |
| A. | 使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- | |
| B. | 由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、HCO3-、SO42- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、AlO2- |
| A. | 3n | B. | 3n+1 | C. | 2n | D. | 2n+1 |
 .
.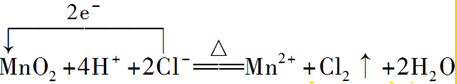 .
.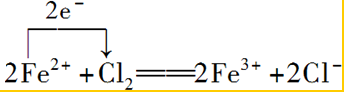 .
.