题目内容
18.稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如图: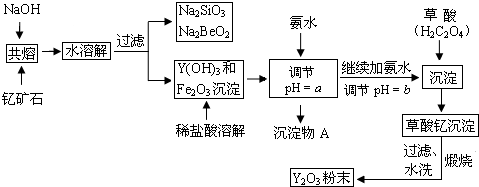
已知①有关金属离子形成氢氧化物沉淀时的pH如表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
分析 钇矿石(Y2FeBe2Si2O10),加入氢氧化钠共熔后水溶过滤得到硅酸钠、铍酸钠溶液,沉淀为Y(OH)3和Fe2O3,加入稀盐酸溶解后加入氨水调节溶液PH在3.7<a<6.0范围沉淀铁离子,继续加入氨水调节溶液PH在8.2以上加入草酸沉淀得到草酸钇,过滤水洗煅烧得到Y2O3,
(1)依据元素化合价和原子守恒书写元素的氧化物组成;
(2)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,所以Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子;
②Na2BeO2与足量盐酸反应生成氯化铍和氯化钠溶液;
(3)依据图表中的PH数据分析判断三价铁离子完全沉淀,钇离子不沉淀的溶液PH为3.7-6.0;检验三价铁离子是否沉淀需要检验滤液中是否含有三价铁离子,结合三价铁离子检验试剂是硫氰酸钾溶液变血红色.
解答 解:(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为:Y2O3•FeO•2BeO•2SiO2,
故答案为:Y2O3•FeO•2BeO•2SiO2;
(2)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,所以Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,
故答案为:b;
②Na2BeO2与足量盐酸发生反应生成氯化铍氯化钠和水,反应的离子方程式为:BeO22-+4H+=Be2++2H2O,
故答案为:BeO22-+4H+=Be2++2H2O;
(3)三价铁离子开始沉淀到沉淀完全的PH范围为:2.7-3.7;钇离子开始沉淀和沉淀完全的PH为:6.0-8.2;所以使Fe3+沉淀完全,须用氨水调节pH=a,3.7<a<6.0;检验三价铁离子是否沉淀需要检验滤液中是否含有三价铁离子,结合三价铁离子检验试剂是硫氰酸钾溶液变血红色;取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀,
故答案为:3.7<a<6.0;取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
点评 本题考查了物质氧化物表示方法,元素化合物性质的类比推断,物质分离试验方法设计,离子分离和离子检验的实验操作,仔细审题,利用题干信息是解题关键,题目难度中等.

| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示.
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2) (填“>”、“<”或“=”);
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+.

(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化.发生的反应如下:2NO(g)+2CO(g)═2CO2 (g)+N2(g)
①已知:N2(g)+O2 (g)═2NO(g)△H=+180.0kJ/mol.部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图1不符合题意的是C(填选项序号).(图中ω、M、v正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸.已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.0kJ/mol.
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图2所示:
则A点的v逆(SO2 )小于(填大于、小于或等于)B点的 v正(SO2).
②在某温度时,向10L的密闭容器中加入4.0molSO2和10.0molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是BC(填选项序号).
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0mol SO2和5.0mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如图3所示.
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用.石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的电极反应式为NO2+NO3--e-=N2O5.相同条件下,消耗的O2和NO2的体积比为1:4.
(4)尾气中氮氧化物(NO和NO2)也可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体.1mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1:1)的质量为76g.
Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知如表数据
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热蒸发、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$ (用含m、n的代数式表示).
①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100m容量瓶⑥95mL容量瓶 ⑦胶头滴管 ⑧玻璃棒.
| A. | ②③⑧⑤⑦ | B. | ③②⑧①⑤⑦ | C. | ④⑤⑧⑥⑦① | D. | ①③⑧⑤⑦ |
| A. | 若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10一a)g Cu(OH)2 | |
| B. | b<a<7 | |
| C. | 阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L | |
| D. | 阴极电极反应式为:Cu2++2e-=Cu |