题目内容
3.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺如下(部分操作和条件略):Ⅰ.将铬铁矿和碳酸钠混合充分焙烧.
Ⅱ.焙烧后的固体加水浸取,分离得到溶液A和固体A.
Ⅲ.向溶液A中加入醋酸调pH约7~8,分离得到溶液B和固体B.
Ⅳ.再向溶液B中继续加醋酸酸化,使溶液pH小于5.
Ⅴ.向上述溶液中加入氯化钾,得到重铬酸钾晶体.
(1)Ⅰ中焙烧发生的反应如下,配平并填写空缺:
4FeO•Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑.
(2)固体A中主要含有Fe2O3、MgO(填写化学式).
(3)已知重铬酸钾溶液中存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O.Ⅳ中调节溶液pH<5时,其目的是由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-.
(4)Ⅴ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,已知如表数据
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
②获得K2Cr2O7晶体的操作有多步组成,依次是:加入KCl固体、加热蒸发、冷却结晶、过滤、洗涤、干燥得到晶体.
(5)Ⅲ中固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析固体B中氢氧化铝含量的方法是:称取n g样品,加入过量氢氧化钠溶液(填写试剂名称)、溶解、过滤、再通入过量的CO2、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26m}{17n}$ (用含m、n的代数式表示).
分析 (1)氧化还原反应中元素化合价有升价就有降价且升价降价相等,再结合元素守恒可得;
(2)焙烧时MgO未反应,焙烧后的固体加水浸取,分离得到固体A为Fe2O3、MgO;
(3)加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-.
(4)①由表可知,温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,低温下得到溶解度更小的物质;
②利用溶解度不同,温度对溶解度影响分析;
(5)固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,为精确分析B中氢氧化铝含量,先利用氢氧化铝的两性,用过量的氢氧化钠溶液溶解氢氧化铝,过滤除去不溶物,向滤液中通入二氧化碳重新生成氢氧化铝沉淀,灼烧得到氧化铝固体,根据铝元素守恒计算样品中氢氧化铝的质量,进而计算其质量分数.
解答 解:(1)反应中Fe、Cr元素化合价升高,方程需要降价的元素,又反应后有氧原子,反应前也应该有,则缺陷物质为氧气,Fe元素化合价由+2价升高为+3价,Cr元素化合价由+3价升高为+6价,总升高+7价,O元素化合价由0价降低为-2价,共降低4价,化合价升降最小公倍数为28,故FeO•Cr2O3的系数为4,氧气系数为7,再根据原子守恒配平后方程式为:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2;
故答案为:4;8;7O2;8;2;8;
(2)焙烧时MgO未反应,焙烧后的固体加水浸取,分离得到固体A为Fe2O3、MgO;
故答案为:Fe2O3、MgO;
(3)由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
故答案为:由于存在反应平衡2CrO42-+2H+?Cr2O72-+H2O,加入酸,氢离子浓度增大,平衡右移,作用是使CrO42-转化为Cr2O72-;
(4)①由图可知:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应在低温下可以得到重铬酸钾;
②加入KCl固体后,利用溶解度不同,温度对溶解度影响,再经过加热浓缩、冷却结晶、过滤、洗涤、干燥可以得到K2Cr2O7晶体;
故答案为:加热蒸发;冷却结晶;
(5)固体B中主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,为精确分析B中氢氧化铝含量,先利用氢氧化铝的两性,用过量的氢氧化钠溶液溶解氢氧化铝,过滤除去不溶物,向滤液中通入二氧化碳重新生成氢氧化铝沉淀,灼烧得到氧化铝固体,
根据Al元素守恒,样品中氢氧化铝的质量分数=$\frac{mg÷102g/mol×2×78g/mol}{ng}$=$\frac{26m}{17n}$;
故答案为:氢氧化钠溶液;$\frac{26m}{17n}$.
点评 本题考查物质制备、物质含量测定、物质的分离提纯、氧化还原反应、平衡移动原理等,题目难度中等,注意对溶解度数据的分析运用,理解复分解反应本质.

| A. | 上述反应均为氧化还原反应 | |
| B. | 反应①、②中氧化剂都是氧气 | |
| C. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中通常发生吸氧腐蚀 |
| A. | 101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-1 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).(1)①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)?2ClNO(g) K3
则K1、K2、K3之间的关系为$\frac{{{K}^{2}}_{1}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl-N=O);
| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
(3)300℃时,2NO(g)+Cl2(g)?2ClNO(g)的正反应速率表达式为v正=k•cn(ClNO),测得速率和浓度的关系如下表:
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
(4)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系
如图A:
①该反应的△H<0(填“>”“<”或“=”).
②反应开始到10min时NO的平均反应速率v(NO)=0.1mol•L-1•min-1
③T2时该反应的平衡常数K=2.
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{l}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点,当$\frac{n(NO)}{n(C{l}_{2})}$=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的D点.
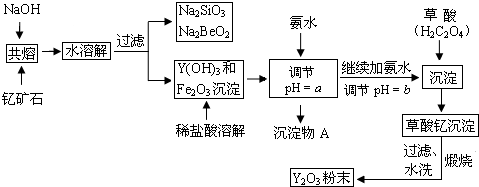
已知①有关金属离子形成氢氧化物沉淀时的pH如表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 脂肪 | B. | 白酒 | C. | 乙酸 | D. | 葡萄糖 |
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |