题目内容
8.常温下,将200mLpH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生.下列说法错误的是( )| A. | 若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10一a)g Cu(OH)2 | |
| B. | b<a<7 | |
| C. | 阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L | |
| D. | 阴极电极反应式为:Cu2++2e-=Cu |
分析 根据题意分析,在聱个电解过程中始终只有一个电极上有气体产生,所以电解池工作时,阳极上氢氧根离子放电,生成氧气;阴极上铜离子得电子生成铜单质,所以电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,电解后生成硫酸的物质的量=(10-b-10-a)mol/L×0.2L=0.2(10-b-10-a)mol.
解答 解:A、要使溶液恢复到原来的浓度,应向电解后的溶液中加入电解时析出的物质,即氧化铜,不是氢氧化铜,故A错误;
B、电解时,阳极上氢氧根离子放电,阴极上铜离子放电,所以导致溶液中氢离子浓度越来越大,溶液的PH值越来越小,即b<a<7,故B正确;
C、阳极上产生的气体是氧气,根据电池反应式计算氧气的体积.
设生成氧气的体积为V.
2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,
2mol 22.4L
0.2(10-b-10-a)mol V
V=1.12(10-b-10-a)L,故C正确;
D、电解时,阴极上溶液中铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D正确.
故选A.
点评 本题以电解原理为载体考查了氧化还原反应的有关计算,难度较大,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
18.稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如图:
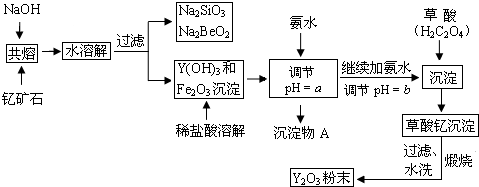
已知①有关金属离子形成氢氧化物沉淀时的pH如表:
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.

已知①有关金属离子形成氢氧化物沉淀时的pH如表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
19.下列有关图象正确的是( )
| A. | 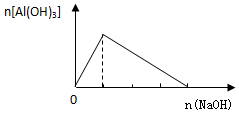 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 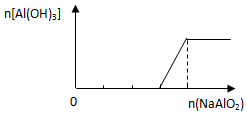 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 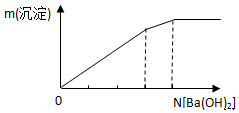 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 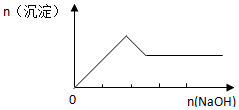 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
16.下列实验可以证明溶液中一定存在大量的HCO3-的是( )
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
13.下列有关有机物的说法正确的是( )
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
18.常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
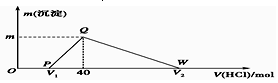

| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
 现有部分元素的存在,性质和原子结构如下所述:
现有部分元素的存在,性质和原子结构如下所述: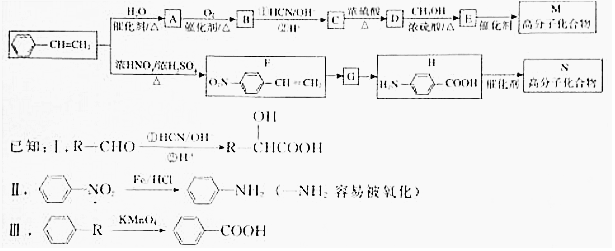
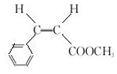 .
. 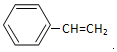 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.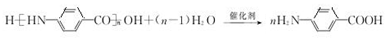 .
.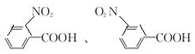 .
.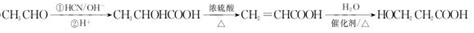 .
.