题目内容
16.黄钠铁矾[NaaFeb(SO4)c(OH)d]具有沉淀颗粒大、沉淀速率快、容易过滤等特点.某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去铁.为测定黄钠铁矾的组成,该小组进行了如下实验:①称取12.125g样品,加盐酸完全溶解后,配成250.00mL溶液A.
②量取25.00mL溶液A,加入足量的KI,再用0.2500mol•L-1Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mL Na2S2O3溶液至终点.
③另取50.00mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330g.
(1)NaaFeb(SO4)c(OH)d中a、b、c、d之间的代数关系式为a+3b=2c+d.
(2)通过计算确定黄钠铁矾的化学式(写出计算过程).
分析 (1)由题给信息,黄钠铁矾[NaaFeb(SO4)c(OH)d]元素化合价代数和为0来分析;
(2)测定黄钠铁矾的原理是,加入碘化钾和黄钠铁矾中铁离子反应生成单质碘,碘和硫代硫酸钠反应,通过消耗硫代硫酸钠的量来计算铁的量,加入足量氯化钡和硫酸根离子生成硫酸钡沉淀,通过硫酸钡沉淀来计算硫酸根离子的量,根据质量守恒和电荷守恒计算钠离子和氢氧根离子的量,根据各微量物质的量之比写出黄钠铁矾的化学式.
解答 解:(1)由题给信息,将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去,黄钠铁矾[NaaFeb(SO4)c(OH)d]中铁元素化合价为+3价,元素化合价代数和为0,a+3b-2c-d=0,得到a+3b=2c+d;
故答案为:a+3b=2c+d;
(2)由相关反应知:n(Fe3+)=2n(I2)=n(Na2S2O3)
250 mL溶液A中:
n(Fe3+)=n(Na2S2O3)=0.2500 mol•L-1×30.00 mL×10-3L•mL-1×10=7.50×10-2 mol
n(SO42-)=$\frac{2.33g}{233g/mol}$×5=5.00×10-2mol
根据质量守恒有:
n(Na+)×23 g•mol-1+n(OH-)×17 g•mol-1
=12.125 g-7.50×10-2 mol×56 g•mol-1-5.00×10-2 mol×96 g•mol-1
根据电荷守恒有:
n(Na+)+7.50×10-2 mol×3=5.00×10-2 mol×2+n(OH-)
解得:
n(Na+)=0.025 mol
n(OH-)=0.150 mol
a:b:c:d=n(Na+):n(Fe3+):n(SO2-4):n(OH-)=1:3:2:6
黄钠铁矾的化学式为NaFe3(SO4)2(OH)6.
答:黄钠铁矾的化学式为NaFe3(SO4)2(OH)6.
点评 本题考查黄钠铁矾组成的测定,中等难度,计算时要搞清反应原理,充分利用质量守恒和电荷守恒计算出钠离子和氢氧根离子的物质的量是解题的关键.要细心计算,注意从250mL中取出25mL进行滴定和形成沉淀,容易出错.

| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)=c(OH-) | |
| B. | 常温下等体积pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 | |
| C. | 常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
| A. | pH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO${\;}_{3}^{-}$、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH${\;}_{4}^{+}$、K+、Cl-、I- | |
| D. | 澄清透明的溶液中:Cu2+、K+、SO${\;}_{4}^{2-}$、Cl- |
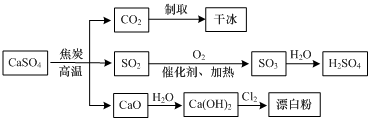
| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
| A. | 上述反应均为氧化还原反应 | |
| B. | 反应①、②中氧化剂都是氧气 | |
| C. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| D. | 钢铁在潮湿的空气中通常发生吸氧腐蚀 |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 标准状况下,2.24L乙烷含有的化学键总数为0.8NA | |
| C. | 常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为NA |

| A. | H2O2的分解反应为放热反应 | |
| B. | 断裂共价键所需的能量:2×E(O-O)<1×E(O=O) | |
| C. | 加入相同物质时,温度越高,H2O2分解的速率越快 | |
| D. | 相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快 |
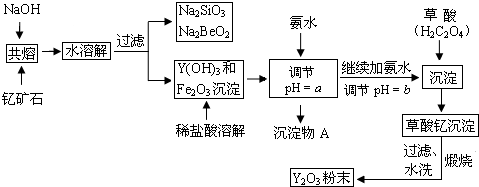
已知①有关金属离子形成氢氧化物沉淀时的pH如表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.