题目内容
7.某实验需要95mL1mol/L的稀硫酸溶液,现用98%的浓硫酸(密度为1.84g/cm3)进行配置,该实验中,按使用仪器先后顺序排列正确的是( )①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100m容量瓶⑥95mL容量瓶 ⑦胶头滴管 ⑧玻璃棒.
| A. | ②③⑧⑤⑦ | B. | ③②⑧①⑤⑦ | C. | ④⑤⑧⑥⑦① | D. | ①③⑧⑤⑦ |
分析 先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解答.
解答 解:98%的浓H2SO4的物资的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,由于无95mL容量瓶,故应选择100mL容量瓶,故配制的是1mol/L的稀硫酸100mL,需要浓硫酸的体积为V═$\frac{0.1L×1mol/L}{18.4mol/L}$=0.0054L,即5.4ml,应选择10ml量筒和胶头滴管,实验时用10ml量筒量取5.4ml浓硫酸,因配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作,所以正确顺序为②③⑧⑤⑦,
故选A.
点评 本题主要考查了配制一定物质的量浓度溶液的操作步骤和使用仪器,难度不大,注意量物质的量浓度和质量百分数之间的换算.

练习册系列答案
相关题目
5.图甲表示的是H2O2分解反应过程中的能量变化.在不同温度下,分别向H2O2溶液(20g•L-1)中加入相同体积且物质的量浓度均为0.5mol•L-1的不同溶液,反应中H2O2浓度随时间的变化如图乙所示.从图中得出的结论不正确的是( )


| A. | H2O2的分解反应为放热反应 | |
| B. | 断裂共价键所需的能量:2×E(O-O)<1×E(O=O) | |
| C. | 加入相同物质时,温度越高,H2O2分解的速率越快 | |
| D. | 相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快 |
18.稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如图:
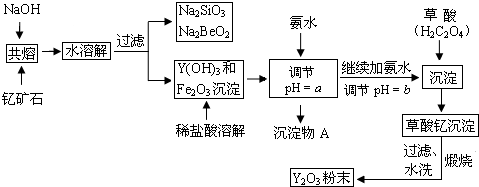
已知①有关金属离子形成氢氧化物沉淀时的pH如表:
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.

已知①有关金属离子形成氢氧化物沉淀时的pH如表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为Y2O3•FeO•2BeO•2SiO2.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,则
①最好选用盐酸、b(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)为使Fe3+沉淀完全,须用氨水调节pH=a,则a应控制在3.7<a<6.0的范围内;检验Fe3+是否沉淀完全的操作方法是取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀.
15.把新制Cu(OH)2悬浊液加入某病人的尿液中,加热后观察到红色沉淀,说明尿液中含有( )
| A. | 脂肪 | B. | 白酒 | C. | 乙酸 | D. | 葡萄糖 |
12.下列反应的离子方程式正确的是( )
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
19.下列有关图象正确的是( )
| A. | 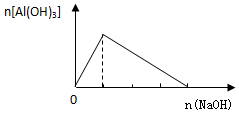 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 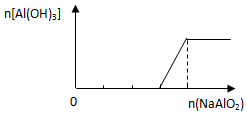 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 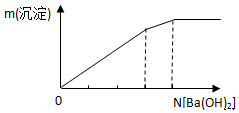 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 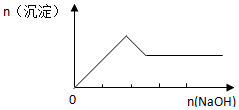 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
16.下列实验可以证明溶液中一定存在大量的HCO3-的是( )
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
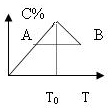 对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度的变化如图所示,则: