题目内容
2.(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H<0.N2O4的物质的量浓度随时间变化如图1,达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: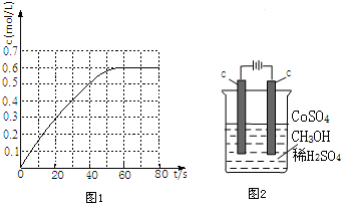
①该反应在降低温度能自发进行(填“较高温度”或“较低温度”).
②下列情况不是处于平衡状态的是a.
a.混合气体的密度保持不变 b.混合气体的颜色不再变化 c.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)=0.6mol n(N2O4)=1.2mol,则:此时v(正)<v(逆)(填“>”、“<”或“=”).
(2)工业上“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4.己知Ksp (CaF2)=1.11×10-10,Ksp (MgF2)=7.40×l0-11,加入过量NaF溶液反应完全后过滤,则滤液中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=1.5.
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用图2装置模拟上述过程,则:Co2+在阳极的电极反应式为:Co2+-e-=Co3+,除去甲醇的离子方程式为6Co3++CH3OH+H2O=CO2+6Co2++6H+.
分析 (1)①该反应是一个焓变小于0、熵减的反应,依据△G=△H-T△S是否小于0;
②可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
③293K时平衡时该反应中c(N2O4)=0.6mol/L,c(NO2)=0.3mol/L,化学平衡常数K=$\frac{0.6}{0.{3}^{2}}$=$\frac{20}{3}$,反应为放热反应,升高温度,K值减小,计算可知此时的浓度商Q=K(298K)>K(398K),反应向逆反应方向移动;
(2)$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{\frac{{K}_{sp}(Ca{F}_{2})}{{c}^{2}({F}^{-})}}{\frac{{K}_{sp}(Mg{F}_{2})}{{c}^{2}({F}^{-})}}$=$\frac{{K}_{sp}(Ca{F}_{2})}{{K}_{sp}(Mg{F}_{2})}$;
(3).Co2+在阳极上失电子发生氧化反应;甲醇被Co3+氧化生成二氧化碳、氢离子和Co2+.
解答 解:(1)①该反应是一个焓变小于0、熵减的反应,△G=△H-T△S可以小于0,所以可以在较低温度下进行,故答案为:较低温度;
②a.反应物和生成物全是气态物质,气体的质量不变,容积为2L保持恒定,由ρ=$\frac{m}{V}$可知气体的密度为一定值,因此气体的密度保持不变不一定处于平衡状态,故a选;
b.混合气体的颜色不变说明NO2的浓度不变,说明反应处于化学平衡状态,故b不选;
c.反应2NO2(g)?N2O4(g)是一个气体体积减小的反应,气压恒定时,正、逆反应速率相等,说明反应处于化学平衡状态,故c不选;
故答案为:a;
③293K时平衡时该反应中c(N2O4)=0.6mol/L,c(NO2)=0.3mol/L,升高温度平衡逆向进行,化学平衡常数减小,化学平衡常数K=$\frac{0.6}{0.{3}^{2}}$=$\frac{20}{3}$,393K时浓度商Q=$\frac{0.6}{0.{3}^{2}}$=$\frac{20}{3}$=K(298K)>K(398K),则反应向逆反应方向移动,故:V(正)<V(逆),
故答案为:<;
(2)$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{\frac{{K}_{sp}(Ca{F}_{2})}{{c}^{2}({F}^{-})}}{\frac{{K}_{sp}(Mg{F}_{2})}{{c}^{2}({F}^{-})}}$=$\frac{{K}_{sp}(Ca{F}_{2})}{{K}_{sp}(Mg{F}_{2})}$=$\frac{1.11×1{0}^{-10}}{7.40×1{0}^{-11}}$=1.5,
故答案为:1.5;
(3)Co2+在阳极上失电子发生氧化反应,电极反应式为Co2+-e-=Co3+;甲醇被Co3+氧化生成二氧化碳、氢离子和Co2+,离子方程式为6Co3++CH3OH+H2O=CO2+6Co2++6H+,
故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2+6Co2++6H+.
点评 本题涉及化学平衡计算、难溶物溶解平衡、电解原理等知识点,侧重考查学生分析计算能力,明确化学反应原理是解本题关键,会根据浓度商与化学平衡常数相对大小确定反应方向,题目难度不大.

| A. | 两溶液混合,AgCl和AgI都沉淀 | |
| B. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| C. | 向AgI的饱和溶液中加AgNO3,c(Ag+)增大,Ksp(AgI)也增大 | |
| D. | 若取0.1435克AgCl固体配成100mL溶液,c(Cl-)为0.01mol/L |
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/kJ•mol-1 | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物本身具有的能量最低的是C
A.HCl B.HBr C.HI D.HF
(3)X2+H2═2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”).
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出的热量最多的是Cl2.
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
| A. | 平衡常数减小 | |
| B. | 平衡逆向移动,氧气的物质的量浓度减小 | |
| C. | 体系的压强不变 | |
| D. | BaO2的量增加 |
| A. | 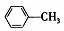 的一溴代物和 的一溴代物和 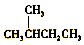 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | C5H11Cl有3种同分异构体 | |
| C. | 按系统命名法,化合物 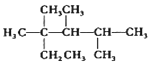 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一直线上 |
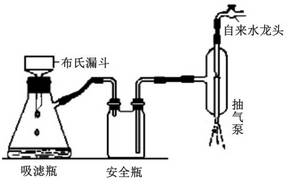
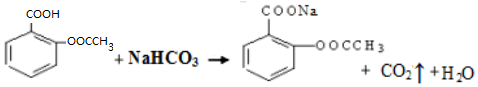
 ),是常用的解热镇痛药,实验室合成流程如下:
),是常用的解热镇痛药,实验室合成流程如下:

 .
.

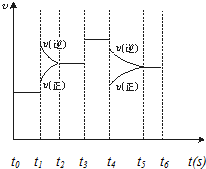 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题: