题目内容
7.表中的数据是断裂1mol物质中的化学键所消耗的能量(kJ):| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/kJ•mol-1 | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物本身具有的能量最低的是C
A.HCl B.HBr C.HI D.HF
(3)X2+H2═2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”).
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出的热量最多的是Cl2.
分析 (1)由表格数据可知,含键能越大,越稳定,则本身能量低;
(2)氢化物越稳定,本身能量越低;
(3)氢气的燃烧反应为放热反应;
(4)消耗等物质的量的氢气时,卤素单质的键能越大,放出的热量越多.
解答 解:(1)由表格数据可知,H2中键能最大,则本身能量低,故答案为:A;
(2)稳定性HF>HCl>HBr>HI,则氢化物本身具有的能量最低的是HF,故答案为:D;
(3)氢气的燃烧反应为放热反应,则X2+H2═2HX(X代表Cl、Br、I)的反应中△H<0,是放热反应,故答案为:放热;
(4)消耗等物质的量的氢气时,卤素单质的键能越大,放出的热量越多,结合表格中数据可知,放出的热量最多的是Cl2,故答案为:Cl2.
点评 本题考查反应热与焓变,为高频考点,把握键能、稳定性、反应中能量变化的关系为解答的关键,侧重分析与应用能力的考查,注意表格数据的应用,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
17.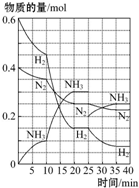 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 反应开始到第一次平衡时,N2的平均反应速率为0.062 5 mol•L-1•min-1,H2的转化率为75% | |
| B. | 反应35 min时,达到第二次平衡时,反应的平衡常数:K=$\frac{0.1{5}^{2}}{0.07{5}^{3}•0.125}$ | |
| C. | 从曲线变化可以看出,反应进行到10~20 min时可能采取的措施是使用了催化剂 | |
| D. | 从曲线变化可以看出,反应进行至25 min时,采取的措施是分离出0.1 mol的氨气,平衡向正方向移动 |
18.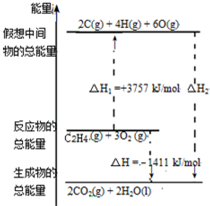 乙烯(C2H4结构式:
乙烯(C2H4结构式: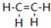 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
 乙烯(C2H4结构式:
乙烯(C2H4结构式: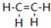 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
15.如表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是第二周期第VA族.
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素②的单质反应,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素②的单质反应,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
12.一定量的混合气体在密闭容器中发生反应:m A (g)+n B (g)?p C (g)达到平衡后,温度不变,将气体体积缩小到原来的$\frac{1}{2}$,达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
| A. | m+n>p | B. | A 的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增加 |
17.下列有关说法正确的是( )
| A. | 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 | |
| B. | 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g);△H<0,则该反应一定能自发进行 | |
| D. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 |
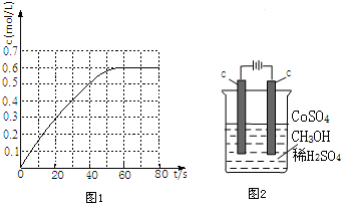
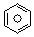 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,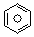 (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)