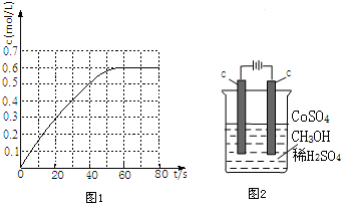
题目内容
17.反应2A(g)+B(g)?2C(g)(吸热反应)下列反应条件有利于生成C的是( )| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
分析 该反应是气体体积减小、吸热的可逆反应,要使该反应向正反应方向移动,可采取加压、升高温度、减小C的浓度、增加反应物的浓度的方法.
解答 解:该反应是气体体积减小、吸热的可逆反应,要使该反应向正反应方向移动,可采取加压、升高温度、减小C的浓度、增加反应物的浓度的方法.
故选C.
点评 本题考查了化学平衡的影响因素,难度不大,注意压强对反应前后气体体积不变的反应无影响.

练习册系列答案
相关题目
7.已知常温下:KSP (AgCl)=1.8×10-10 mol2•L-2,KSP (Ag2CrO4)=1.9×10-12 mol2•L-2,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgBr) | |
| C. | 将0.001 mol•L- 1 的AgNO3 溶液滴入0.001 mol•L- 1 的KCl和0.001 mol•L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
8.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表.
(1)反应前4min的平均速率v(CO2)=0.225 mol/(L.min)
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
5. 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A. | (a)甲>乙,(b)甲>乙 | B. | (a)甲>乙,(b)甲=乙 | C. | (a)甲<乙,(b)甲>乙 | D. | (a)甲>乙,(b)甲<乙 |
12.下列有关说法正确的是( )
| A. | 已知:HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2 H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |
9.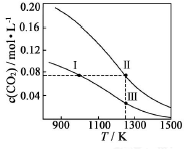 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ) | |
| C. | 体系中c(CO2):c(CO2,状态Ⅱ)<3c(CO2,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
6.从海带中提取碘的实验过程,正确的是( )

| A. | ①将海带灼烧成灰 | B. | ②过滤海带灰得到含I-的溶液 | ||
| C. | ③放出碘的苯溶液 | D. | ④分离碘并回收苯 |
7.常温下,下列有关离子浓度及pH大小的比较正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |