题目内容
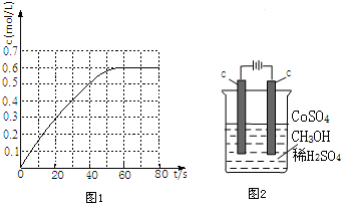
11.将BaO2放入密闭的真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡.保持温度不变,体积压缩为原来的一半,体系重新达到平衡,下列说法正确的是( )| A. | 平衡常数减小 | |
| B. | 平衡逆向移动,氧气的物质的量浓度减小 | |
| C. | 体系的压强不变 | |
| D. | BaO2的量增加 |
分析 保持温度不变,缩小容器体积,增大压强,可逆反应向逆反应方向移动,化学平衡常数只与温度有关,据此分析解答.
解答 解:A.化学平衡常数只与温度有关,温度不变,平衡常数不变,故A错误;
B.缩小容器体积,增大压强,氧气的物质的量浓度增加,平衡向逆反应方向移动,故B错误;
C.平衡向逆反应方向移动,但温度不变,平衡常数不变,氧气浓度不变,其压强不变,故C正确;
D.平衡向逆反应方向移动,则BaO2量增加,故D正确;
故选CD.
点评 本题考查了可逆反应平衡移动,根据压强与平衡移动方向之间的关系分析解答即可,注意平衡常数只与温度有关,与物质浓度无关,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.根据平衡移动的原理,能说明提高氨的产量的措施是( )
| A. | 及时把生成的氨液化分离 | B. | 升温有利于氨的生成 | ||
| C. | 使用催化剂促进氮的转化 | D. | 增大压强,不利于氨的生成 |
6.从海带中提取碘的实验过程,正确的是( )

| A. | ①将海带灼烧成灰 | B. | ②过滤海带灰得到含I-的溶液 | ||
| C. | ③放出碘的苯溶液 | D. | ④分离碘并回收苯 |
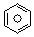 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,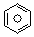 (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)


