题目内容
13.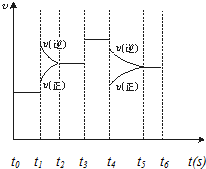 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:(1)处于平衡状态的时间段是t0~t1、t2~t3、t3~t4、t5~t6 .?
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
t1:升温,t3:加催化剂,t4:减压.
(3)下列各时间段时,氨的体积分数最高的是A?
A.t0~t1B.t2~t3C.t3~t4D.t5~t6.
分析 (1)正逆反应速率相等时,可逆反应达到平衡状态;
(2)t1时正逆反应速率都增大,且平衡逆向移动;
t3时正逆反应速率都增大且相等,平衡不移动;
t4时正逆反应速率都减小且平衡逆向移动;
(3)该反应平衡越向正反应方向移动,氨气的物质的量越多,其体积分数越大.
解答 解:(1)正逆反应速率相等时,可逆反应达到平衡状态,根据图知,只要是正逆反应速率相等的状态都是平衡状态,则处于化学平衡状态的有t0~t1、t2~t3、t3~t4、t5~t6 ,故答案为:t0~t1、t2~t3、t3~t4、t5~t6 ;
(2)该反应的正反应是一个反应前后气体体积减小的放热反应,
t1时正逆反应速率都增大,且平衡逆向移动,改变的条件是升温;
t3时正逆反应速率都增大且相等,平衡不移动,改变的条件是加催化剂;
t4时正逆反应速率都减小且平衡逆向移动,改变的条件是减压,
故答案为:升温;加催化剂;减压;
(3)该反应平衡越向正反应方向移动,氨气的物质的量越多,其体积分数越大,
t0~t1时平衡状态、t1~t2时逆向移动、t2~t3平衡状态、C.t3~t4时平衡状态、t4~t5逆向移动、t5~t6平衡状态,所以氨气最多的是t0~t1,则氨气体积分数最大是t0~t1,
故选.A.
点评 本题考查图象分析,为高频考点,侧重考查学生分析判断能力,明确正逆反应速率相对大小与移动方向关系、外界条件对化学平衡移动影响原理是解本题关键,题目难度不大.

练习册系列答案
相关题目
18.青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.它的分子式为C15H22O5.关于青蒿素的说法正确的是( )
| A. | 2.82g青蒿素含氧原子数目为0.05NA | |
| B. | 标准状况下,1 mol青蒿素的体积为22.4 L | |
| C. | 青蒿素含氧量为10% | |
| D. | 青蒿素的摩尔质量为282 |
4.在1.0L密闭容器中放入0.10mol A(g),在一定温度进行如下反应:A(g)═B(g)+C(g)△H=+85.1kJ•mol-1
反应时间(t)与容器内气体总压强(p)的数据见表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为升高温度、降低压强;(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.平衡时A的转化率为94.1%,列式并计算反应的平衡常数K1.5mol/L.
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=$\frac{0.10P}{{P}_{0}}$ mol,n(A)=0.10×(2-$\frac{P}{P0}$) mol.
反应时间(t)与容器内气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(1)欲提高A的平衡转化率,应采取的措施为升高温度、降低压强;(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.平衡时A的转化率为94.1%,列式并计算反应的平衡常数K1.5mol/L.
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=$\frac{0.10P}{{P}_{0}}$ mol,n(A)=0.10×(2-$\frac{P}{P0}$) mol.
1.根据平衡移动的原理,能说明提高氨的产量的措施是( )
| A. | 及时把生成的氨液化分离 | B. | 升温有利于氨的生成 | ||
| C. | 使用催化剂促进氮的转化 | D. | 增大压强,不利于氨的生成 |
8.在一定温度下,将6mol CO2和8mol H2充入2L恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表.
(1)反应前4min的平均速率v(CO2)=0.225 mol/(L.min)
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
(2)达到平衡时速率之比V(CO2):V(H2):V(CH3OH):V(H2O)=1:3:1:1
(3)达到平衡时,H2的转化率为75%,CO2平衡浓度是2mol/L
(4)其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数(填变大,不变,减小)减小
(5)该温度下,该反应的平衡常数为0.5
(6)达到平衡时降低温度,平衡向正反应移动,达到平衡时速率与原平衡速率比较(填变大,不变,减小)减小.
18.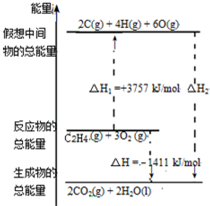 乙烯(C2H4结构式:
乙烯(C2H4结构式: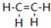 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
 乙烯(C2H4结构式:
乙烯(C2H4结构式: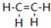 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
5. 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A. | (a)甲>乙,(b)甲>乙 | B. | (a)甲>乙,(b)甲=乙 | C. | (a)甲<乙,(b)甲>乙 | D. | (a)甲>乙,(b)甲<乙 |