题目内容
10.常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )| A. | 两溶液混合,AgCl和AgI都沉淀 | |
| B. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| C. | 向AgI的饱和溶液中加AgNO3,c(Ag+)增大,Ksp(AgI)也增大 | |
| D. | 若取0.1435克AgCl固体配成100mL溶液,c(Cl-)为0.01mol/L |
分析 饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,溶液中c(Cl-)>c(I-),以此解答该题.
解答 解:饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,
A.等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,明显,混合后,AgI必然沉淀,AgCl则不然,故A错误;
B.由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,故B正确;
C.Ksp与温度有关,温度不变,Ksp不变,故C错误;
D.常温下,氯化银的溶解度为:1.342×10-5×143.5═0.00192(g),c(Cl-)═1.342×10-5mol/L,0.1435克AgCl只有少量溶解,故c(Cl-)═1.342×10-5mol/L,故D错误.
故选B.
点评 本题考查难溶电解质的生成,为高频考点,把握AgI更难溶且碘离子浓度小为解答的关键,侧重分析与应用能力的考查,注意沉淀生成的判断,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
1.根据平衡移动的原理,能说明提高氨的产量的措施是( )
| A. | 及时把生成的氨液化分离 | B. | 升温有利于氨的生成 | ||
| C. | 使用催化剂促进氮的转化 | D. | 增大压强,不利于氨的生成 |
18.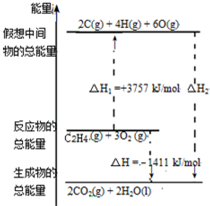 乙烯(C2H4结构式:
乙烯(C2H4结构式: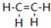 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
 乙烯(C2H4结构式:
乙烯(C2H4结构式: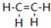 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
5. 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
 常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进行下列两实验:(已知:N2O4(g)?2NO2(g)△H>0)(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
| A. | (a)甲>乙,(b)甲>乙 | B. | (a)甲>乙,(b)甲=乙 | C. | (a)甲<乙,(b)甲>乙 | D. | (a)甲>乙,(b)甲<乙 |
15.如表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是第二周期第VA族.
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素②的单质反应,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素②的单质反应,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
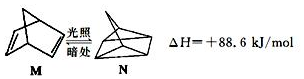
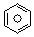 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1,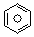 (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)