��Ŀ����
14����һ������ȼ�ϵ�أ�һ��ͨ���������һ��ͨ�붡�����壻������Dz��������ƣ�Y2O3��������ﯣ�ZrO2�����壬������״̬���ܴ���O2-�����жԸ�ȼ�ϵ�ص�˵������ȷ���ǣ�������| A�� | �����ڵ�����У�O2-�ɸ����������� | |
| B�� | ��ص��ܷ�Ӧ�� 2C4H10+13O2=8CO2+10H2O | |
| C�� | ͨ�������һ�����������缫��ӦΪ O2+4e-=2O2- | |
| D�� | ͨ�붡���һ���Ǹ������缫��ӦΪ C4H10+13O2-+26e-=4CO2+5H2O |
���� ������л�ԭ�ԣ�Ϊԭ��صĸ��������������缫��ӦʽΪC4H10+13O2--26e-=4CO2+5H2O��ͨ�������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e-=2O2-���ܷ�ӦʽΪ2C4H10+13O2��8CO2+10H2O���Դ˽����⣬ע�����ʺ����ӵĶ����ƶ�����
��� �⣺A��ԭ��������������ƶ����������������ƶ�������O2-��������A����
B����ص��ܷ�Ӧ�붡��ȼ�յĻ�ѧ����ʽһ�£�Ϊ2C4H10+13O2=8CO2+10H2O����B��ȷ��
C��ͨ�������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪO2+4e-=2O2-����C��ȷ��
D��ͨ�붡��һ���Ǹ�����ʧ���ӱ��������缫��ӦʽΪC4H10+13O2--26e-=4CO2+5H2O����D����
��ѡAD��
���� ���⿼��ԭ���֪ʶ����Ŀ�Ѷ��еȣ�ע��������ҺΪ��ˮ���ʣ���Ϊ����Ĺؼ���

��ϰ��ϵ�д�
 ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
�����Ŀ
4����1.0L�ܱ������з���0.10mol A��g������һ���¶Ƚ������·�Ӧ��A��g���TB��g��+C��g����H=+85.1kJ•mol-1
��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ�����
�ش��������⣺
��1�������A��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ�����¶ȡ�����ѹǿ����д�������ʩ����
��2������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽΪ��$\frac{P}{{P}_{0}}$-1����100%��ƽ��ʱA��ת����Ϊ94.1%����ʽ�����㷴Ӧ��ƽ�ⳣ��K1.5mol/L��
��3������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A����n���ܣ�=$\frac{0.10P}{{P}_{0}}$ mol��n��A��=0.10����2-$\frac{P}{P0}$�� mol��
��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ�����
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
��1�������A��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ�����¶ȡ�����ѹǿ����д�������ʩ����
��2������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽΪ��$\frac{P}{{P}_{0}}$-1����100%��ƽ��ʱA��ת����Ϊ94.1%����ʽ�����㷴Ӧ��ƽ�ⳣ��K1.5mol/L��
��3������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A����n���ܣ�=$\frac{0.10P}{{P}_{0}}$ mol��n��A��=0.10����2-$\frac{P}{P0}$�� mol��
5�� ���³�ѹ�£��ס���������������ͬ�����Ļ������ݻ���ȣ���������ʢ�ж����������壬��������ʢ�п������ֱַ����������ʵ�飺����֪��N2O4��g��?2NO2��g����H��0��
���³�ѹ�£��ס���������������ͬ�����Ļ������ݻ���ȣ���������ʢ�ж����������壬��������ʢ�п������ֱַ����������ʵ�飺����֪��N2O4��g��?2NO2��g����H��0��
��a�������������ڷ�ˮ�м���
��b���ڻ����϶���2kg������
������������£����������������С�ıȽϣ���ȷ���ǣ�������
 ���³�ѹ�£��ס���������������ͬ�����Ļ������ݻ���ȣ���������ʢ�ж����������壬��������ʢ�п������ֱַ����������ʵ�飺����֪��N2O4��g��?2NO2��g����H��0��
���³�ѹ�£��ס���������������ͬ�����Ļ������ݻ���ȣ���������ʢ�ж����������壬��������ʢ�п������ֱַ����������ʵ�飺����֪��N2O4��g��?2NO2��g����H��0����a�������������ڷ�ˮ�м���
��b���ڻ����϶���2kg������
������������£����������������С�ıȽϣ���ȷ���ǣ�������
| A�� | ��a���ף��ң���b���ף��� | B�� | ��a���ף��ң���b����=�� | C�� | ��a���ף��ң���b���ף��� | D�� | ��a���ף��ң���b���ף��� |
9��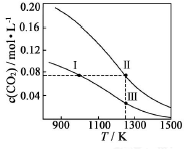 �������Ϊ1.0L�ĺ����ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1molCO2��0.3molCO2���ڲ�ͬ�¶��·�ӦCO2��g��+C��s��?2CO��g���ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c��CO2�����¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ���ǣ�������
�������Ϊ1.0L�ĺ����ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1molCO2��0.3molCO2���ڲ�ͬ�¶��·�ӦCO2��g��+C��s��?2CO��g���ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c��CO2�����¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ���ǣ�������
 �������Ϊ1.0L�ĺ����ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1molCO2��0.3molCO2���ڲ�ͬ�¶��·�ӦCO2��g��+C��s��?2CO��g���ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c��CO2�����¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ���ǣ�������
�������Ϊ1.0L�ĺ����ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1molCO2��0.3molCO2���ڲ�ͬ�¶��·�ӦCO2��g��+C��s��?2CO��g���ﵽƽ�⣬ƽ��ʱCO2�����ʵ���Ũ��c��CO2�����¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ���ǣ�������| A�� | ��ӦCO2��g��+C��s��?2CO��g����S��0����H��0 | |
| B�� | ��ϵ����ѹǿP�ܣ�P�ܣ�״̬��3P�ܣ�״̬�� | |
| C�� | ��ϵ��c��CO2����c��CO2��״̬��3c��CO2��״̬�� | |
| D�� | �淴Ӧ����V�棺V�棨״̬��V�棨״̬�� |
6���Ӻ�������ȡ���ʵ����̣���ȷ���ǣ�������

| A�� | �ٽ��������ճɻ� | B�� | �ڹ��˺����ҵõ���I-����Һ | ||
| C�� | �۷ų���ı���Һ | D�� | �ܷ���Ⲣ���ձ� |
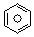 ��l����ȼ����Ϊ3267.5kJ•mol-1��
��l����ȼ����Ϊ3267.5kJ•mol-1��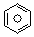 ��l��+6O2��g���T6CO2��g��+3H2��g��
��l��+6O2��g���T6CO2��g��+3H2��g��