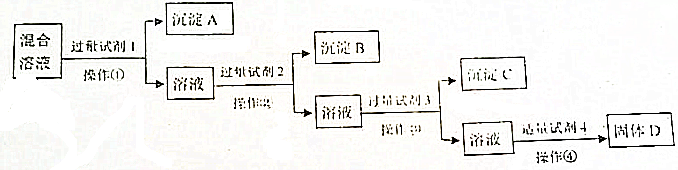
题目内容
13.某氮肥厂氨氮废水中的氮元素多以NH${\;}_{4}^{+}$和NH3•H2O的形式存在,该废水的处理流程如图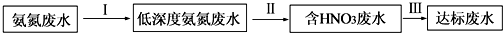
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收.用离子方程式表示甲NaOH溶液的作用:NH4++OH-═NH3•H2O,升温至30℃的作用是降低氨气的溶解度
(2)请指出过程Ⅲ的一种措施,使“达标废水”能浇灌农田:向废水中加入CH3OH,将HNO3还原成N2.
分析 (1)铵根能和强碱反应生成一水合氨,升高温度,气体溶解度减小;
(2)硝酸具有强氧化性,可加入还原剂.
解答 解:(1)铵盐能和强碱反应,实质是:NH4++OH-═NH3•H2O,升高温度,降低氨气的溶解度,通入空气,易于分离氨气,
故答案为:NH4++OH-═NH3•H2O;降低氨气的溶解度;
(2)硝酸具有强氧化性,可在硝酸废水中加入甲醇,发生氧化还原反应生成氮气和二氧化碳气体,故答案为:向废水中加入CH3OH,将HNO3还原成N2.
点评 本题综合考查物质的分离提纯,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关物质的性质以及氧化还原反应,难度不大.

练习册系列答案
相关题目
3.下列说法错误的是( )
| A. | 碱性锌锰电池是二次电池 | |
| B. | 铅蓄电池是二次电池 | |
| C. | 二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生 | |
| D. | 燃料电池的活性物质没有储存在电池内部 |
4.下列物质不能用作食品干燥剂的是( )
| A. | 硅胶 | B. | 六水合氯化钙 | ||
| C. | 碱石灰 | D. | 具有吸水性的植物纤维 |
14.CuSO4、Fe2(SO4)3的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多溶解铁粉的质量为( )
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
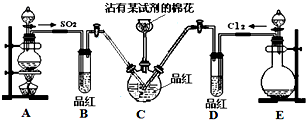 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.