题目内容
2.将两种不含结晶水的白色晶体A和B以等物质的量混合后,放入硬质试管中,加强热能放出无色气体C,C溶于水至饱和,得无色液体D,将试管内残留的固体E取出,溶于水,其水溶液里+1价的阳离子的离子结构示意图为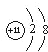 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
分析 将试管内残留的固体E取出,溶于水,其水溶液里+1价的阳离子的离子结构示意图为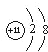 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀,所以阳离子是钠离子,阴离子是硫酸根离子,D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,应该是制取氯气的过程,氯水能使石蕊溶液变红后褪色,所以D是盐酸溶液,则A是硫酸氢钠,B是氯化钠,二者放入硬质试管中,加强热能放出无色气体C即HCl,据此分析解答.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀,所以阳离子是钠离子,阴离子是硫酸根离子,D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,应该是制取氯气的过程,氯水能使石蕊溶液变红后褪色,所以D是盐酸溶液,则A是硫酸氢钠,B是氯化钠,二者放入硬质试管中,加强热能放出无色气体C即HCl,据此分析解答.
解答 解:将试管内残留的固体E取出,溶于水,其水溶液里+1价的阳离子的离子结构示意图为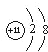 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀,所以阳离子是钠离子,阴离子是硫酸根离子,D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,应该是制取氯气的过程,氯水能使石蕊溶液变红后褪色,所以D是盐酸溶液,则A是硫酸氢钠,B是氯化钠,二者放入硬质试管中,加强热能放出无色气体C即HCl,综上分析,得到:A:NaHSO4,B:NaCl,C:HCl,D:盐酸,E:Na2SO4;发生的反应有:NaHSO4+NaCl$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+HCl↑,Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3,2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑,
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀,所以阳离子是钠离子,阴离子是硫酸根离子,D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,应该是制取氯气的过程,氯水能使石蕊溶液变红后褪色,所以D是盐酸溶液,则A是硫酸氢钠,B是氯化钠,二者放入硬质试管中,加强热能放出无色气体C即HCl,综上分析,得到:A:NaHSO4,B:NaCl,C:HCl,D:盐酸,E:Na2SO4;发生的反应有:NaHSO4+NaCl$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+HCl↑,Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3,2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑,
故答案为:A:NaHSO4,B:NaCl,C:HCl,D:盐酸,E:Na2SO4;发生的反应有:NaHSO4+NaCl$\frac{\underline{\;加热\;}}{\;}$Na2SO4+HCl↑,Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3,2KMnO4+16HCl(浓)═2KCl+2MnCl2+8H2O+5Cl2↑.
点评 本题是一道物质的分离和检验知识的题目,注意物质的性质以及反应的明显现象是解题的关键,难度中等.

 小题狂做系列答案
小题狂做系列答案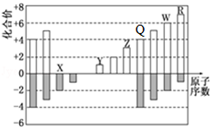
| A. | 原子半径:Z>Y>X | |
| B. | X和Z形成的化合物能溶于NaOH溶液 | |
| C. | Q和X形成的化合物不能与酸反应 | |
| D. | R元素的含氧酸和W元素的含氧酸,酸性一定前者强 |
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
| A. | 5.6 g | B. | 11.2 g | C. | 22.4 g | D. | 20.16 g |
| A. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 | |
| B. | SO2是大气污染物,可以用生石灰除去工业废气中的SO2 | |
| C. | 明矾水解产生Al(OH)3胶体粒子,可除去悬浮物 | |
| D. | 使用清洁能源是防止酸雨发生的重要措施之一 |
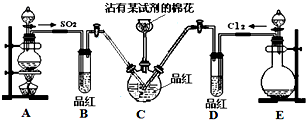 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.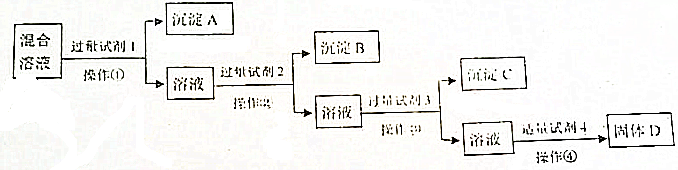

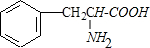 .
.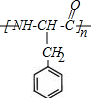 .
.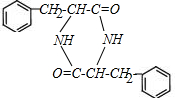 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).