题目内容
16.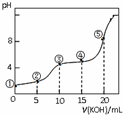 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.该点溶液中溶质为任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.点④溶液中存在等物质的量浓度的K2C2O4和KHC2O4,根据物料守恒判断;
D.该点溶液中二者恰好完全反应,溶液中溶质为K2C2O4,草酸根离子水解导致溶液呈碱性,但其水解程度较小.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A错误;
B.二者恰好完全反应生成KHC2O4,该点溶液中溶质为任何电解质溶液中都存在物料守恒,根据物料守恒得c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C.点④溶液中存在等物质的量浓度的K2C2O4和KHC2O4,由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=$\frac{0.05mol/L×(0.015+0.01)L}{(0.015+0.01)L}$=0.05mol•L-1,故C正确;
D.该点溶液中二者恰好完全反应,溶液中溶质为K2C2O4,草酸根离子水解导致溶液呈碱性,但其水解程度较小,所以c(HC2O4-)<c(C2O42-),故D错误;
故选AD.
点评 本题以酸碱混合定性判断为载体考查离子浓度大小比较,明确混合溶液中溶质及其性质、溶液酸碱性是解本题关键,会灵活运用电荷守恒和物料守恒,易错选项是C.

练习册系列答案
相关题目
6.下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题.
(1)化学性质最不活泼的元素是氩(填元素名称);
(2)N原子结构示意图为 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第2周期中气态氢化物最稳定的是H2O;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是集成电路、半导体等(写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是NaCl该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2.
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)N原子结构示意图为
 ;Ca的最外层电子数为2.
;Ca的最外层电子数为2.(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第2周期中气态氢化物最稳定的是H2O;(填化学式);
(6)Si是带来人类文明的重要元素之一,晶体硅的主要用途是集成电路、半导体等(写出一种).
(7)海洋是大自然赐予人类的宝物.从中可以提取的第一大类物质是NaCl该物质的焰色反应为黄色,它暴露在空气中易潮解是因为还含有MgCl2.
(8)Na、Al最高价氧化物的水化物之间反应的化学方程式是NaOH+Al(OH)3=NaAlO2+2H2O.
7.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生.为探究其反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是( )
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 溶液中OH?氧化了Mg |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中Mg也可被氧化 |
| A. | A | B. | B | C. | C | D. | D |
4.下列物质不能用作食品干燥剂的是( )
| A. | 硅胶 | B. | 六水合氯化钙 | ||
| C. | 碱石灰 | D. | 具有吸水性的植物纤维 |
11.已知酸性溶液中还原性的顺序为SO32->I->Fe2+>Br->Cl-,下列反应不能发生的是( )
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
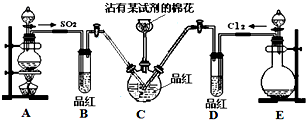 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.