题目内容
20.已知A、B、C、D、E、F、G为元素周期表中原子序数依次增大的前四周期元素,A、B、C位于同一周期,A元素基态原子最外层p轨道上的电子数等于前一电子层电子总数,C元素基态原子核外有3对成对电子;D的是所在周期中原子半径最大的一种元素.C和D可形成核外电子排布相同的简单离子,DE、FC为电子数相同的离子晶体.G原子M层为全充满状态,且核外的未成对电子只有一个.请回答下列问题(答题时,用对应的元素符号表示):A、B、C三种元素的第一电离能由小到大的顺序为C<O<N,DE的晶格能小于(填“大于”、“小于”或“等于”)FC的晶格能.分析 A原子的最外层中p轨道上的电子数等于前一电子层电子总数,原子只能有2个电子层,最外层电子数为4,则A为碳元素,C元素基态原子核外有3对成对电子,核外电子排布为1s2s22p4,则C为氧元素;A、B、C原子序数依次增大,且同周期,所以B为氮元素;D的是所在周期中原子半径最大的一种元素,处于IA族,且C和D可形成核外电子排布相同的简单离子,则D为Na;DE、FC为电子数相同的离子晶体,E表现-1价、F表现+2价,可推知E为F、F为Mg;G原子M层为全充满状态,且核外的未成对电子只有一个,原子核外电子数为2+8+18+1=29,故G为Cu,据此解答.
解答 解:A原子的最外层中p轨道上的电子数等于前一电子层电子总数,原子只能有2个电子层,最外层电子数为4,则A为碳元素,C元素基态原子核外有3对成对电子,核外电子排布为1s2s22p4,则C为氧元素;A、B、C原子序数依次增大,且同周期,所以B为氮元素;D的是所在周期中原子半径最大的一种元素,处于IA族,且C和D可形成核外电子排布相同的简单离子,则D为Na;DE、FC为电子数相同的离子晶体,E表现-1价、F表现+2价,可推知E为F、F为Mg;G原子M层为全充满状态,且核外的未成对电子只有一个,原子核外电子数为2+8+18+1=29,故G为Cu.
同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,能量较低第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能由小到大的顺序为:C<O<N;
DE为NaF、FC为MgO,晶格能主要由电荷影响,NaF中离子所带电荷比较MgO中小,NaF的晶格能小于MgO的晶格能,
故答案为:C<O<N;小于.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、晶体类型与性质等,侧重考查学生分析推理能力,难度中等.

| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
| A. | 2Fe3++SO32-+H2O→2Fe2++SO42-+2H+ | |
| B. | I2+SO32-+H2O→SO42-+2I-+2H+ | |
| C. | 2Fe2++I2→2Fe3++2I- | |
| D. | Br2+SO32-+H2O→SO42-+2Br-+2H+ |
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
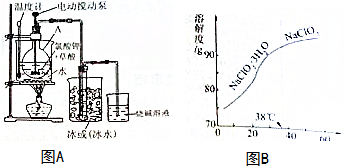
(1)仪器A的名称是圆底烧瓶
(2)温度计的作用是测量反应温度,使用电动搅拌泵搅拌反应混合物的目的是增大反应速率
(3)保存液态ClO2的条件是d(填字母)
a.常温、密封、不避光 b.低温、敞口、不避光 c.常温、敞口、避光 d.低温、密封、避光
(4)烧碱溶液的作用是吸收尾气
(5)亚氯酸钠(NaClO2)也可用于二氧化氯的制备
①观察亚氯酸钠的溶解度曲线图B,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是减压蒸发,温度略高于(或大于)38℃
②设计实验方案,验证酸性条件下亚氯酸钠的氧化性强于碘(I2)在淀粉碘化钾溶液中加入少量NaClO2溶液,并加入少量的稀硫酸,溶液变蓝说明亚氯酸钠的氧化性强于碘
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:
| 实验设计及操作 | 离子方程式 |
| Ⅰ.向盛有2mlCuSO4溶液的试管里加入2mlNaOH溶液,观察现象 | Cu2++2OH-═Cu(OH)2↓ |
| Ⅱ.向盛有2mL pH=1的HCl溶液的试管里慢慢滴入18mL(已足量)CH3COONH4溶液(查资料知CH3COONH4,溶液呈中性 )震荡摇匀,测得pH≈3.7 | |
| Ⅲ向盛有2mLNaHCO3溶液的试管里加入2mL H2SO4溶液,观察现象 | HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
| Ⅳ向盛有2mL 稀Na2SO4溶液的试管里加入2mL稀KCl溶液,观察无明显现象 |  |
②根据实验发现只要有气体、沉淀、弱电解质等物质生成,水溶液中复分解型离子反应就可以发生.
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些离子浓度减小 的方向进行(与溶液混合的瞬间相比).
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题.请你结合化学反应原理的相关知识对③中的结论作出合理解释:当生成上述三类物质时,形成新的化学键而导致体系的焓减或生成气体而导致熵增,由化学反应进行的方向的焓判据和熵判据知,反应可发生.
(2)如何研究H2SO4、KC1、NaHSO4、NaN03、Na2C03、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验,具体如下:
①根据方案进行分类时,经实验测得KC1、NaN03,溶液的pH=7;
H2SO4、NaHSO4、NH4Cl溶液的pH<7;
Na2C03、NaOH溶液的pH>7.
由此有的同学按分类法思想把H2SO4、NaHSO4、NH4Cl都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由.不合理、硫酸氢钠和氯化铵都属于盐,前者电离产生的阳离子除了氢离子还有钠离子,后者是因为水解而显酸性.
②向NaHS04、NaN03的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:2NO3-+3S2-+8H+=2NO↑+3S↓+4H2O.反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为0.075mol,转移电子的物质的量为0.15mol.
③某同学在用H2S04鉴别NaN03、Na2C03、NaOH溶液时,Na2C03很容易鉴别,但鉴别NaN03和NaOH时却陷入了困境.限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题:
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
