题目内容
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
分析 为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,应先加入Ba(NO3)2,除去SO42-,然后加入过量的KOH,除去Mg2+,再加入过量的K2CO3,除去Ca2+和Ba2+,最后加入HNO3除去K2CO3和KOH.
解答 解:为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,应先加入Ba(NO3)2,生成BaSO4,除去SO42-,然后加入过量的KOH,生成Mg(OH)2,除去Mg2+,再加入过量的K2CO3,生成CaCO3和BaCO3沉淀,除去Ca2+和Ba2+,最后加入HNO3除去K2CO3和KOH,注意不能先加K2CO3,否则不能除去过量的Ba2+.
故选A.
点评 本题考查除杂的实验设计,为高考常见题型,侧重于学生的分析、实验能力的考查,题目难度中等,注意除杂时要考虑不能引入新的杂质,注意本题中加入K2CO3的作用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.将10molA和5molB放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2min内,消耗A 3.6mol,则在2min时,C的平均速率是( )
| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
13.下列有关化学用语的表述正确的是( )
| A. | CO2的比例模型: | |
| B. | N2H4的电子式为: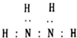 | |
| C. | NaH中氢离子结构示意图为: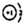 | |
| D. | 质子数是82,中子数是122的铅原子:${\;}_{82}^{122}$Pb |
10.相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷.此氯代烷0.5mol可与3mol氯气发生完全取代反应,则该烃的结构简式为( )
| A. | CH3CH3 | B. | CH2═CH2 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
7.下列有关说法正确的是( )
| A. | 铜的金属活动性比铁弱,可以用铜罐代替铁罐盛装和运输浓硝酸 | |
| B. | 明矾净水与铁粉作食品的脱氧剂都利用了物质的还原性 | |
| C. | 钢瓶可以运输液氯 | |
| D. | 用氧化铝制成的耐高温坩埚可以用于熔融氢氧化钠 |
14.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 标准状况下,1 molCH2Cl2所占有的体积约为22.4L | |
| C. | 常温常压下,38g 18OH-中含质子数20NA | |
| D. | 14g C2H4和C3H6的混合气体含有的原子总数为3NA |
11.下列有关物质的结构的说法正确的是( )
| A. | 3.4g氨气中含有0.6NA个N-H键 | |
| B. | 78g Na2O2晶体中所含阴阳离子个数均为4NA | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 |
10.下列递变情况中,正确的是( )
| A. | C、N、O的原子半径依次减小 | |
| B. | Si、P、S元素的最高正价依次降低 | |
| C. | Na、Mg、Al原子的最外层电子数依次减少 | |
| D. | Li、Na、K的金属性依次减弱 |