题目内容
10.相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷.此氯代烷0.5mol可与3mol氯气发生完全取代反应,则该烃的结构简式为( )| A. | CH3CH3 | B. | CH2═CH2 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
分析 碳碳双键和氯气发生加成反应时其物质的量之比为1:1,相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷,说明该烃中只含一个碳碳双键;烃和氯气发生取代反应时,被取代的H原子的物质的量与氯气的物质的量之比为1:1,此氯代烷0.5mol可与3mol氯气发生完全取代反应,说明该氯代烃中含有6个H原子,据此分析解答.
解答 解:碳碳双键和氯气发生加成反应时其物质的量之比为1:1,相同条件下,1体积某气态烃只能与1体积氯气发生加成反应,生成氯代烷,说明该烃中只含一个碳碳双键;烃和氯气发生取代反应时,被取代的H原子的物质的量与氯气的物质的量之比为1:1,此氯代烷0.5mol可与3mol氯气发生完全取代反应,说明该氯代烃中含有6个H原子,所以该烃中含有1个碳碳双键、6个H原子,则符合条件的为C,故选C.
点评 本题考查有机物分子式的确定,为高频考点,侧重考查学生分析判断能力,明确烃发生加成反应碳碳不饱和键与氯气物质的量关系、烃和氯气发生取代反应时氢原子个数与氯气物质的量关系是解本题关键,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
1.下列是说法正确的是( )
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
18.下列操作不能用于检验NH3的是( )
| A. | 气体使酚酞试液变红 | B. | 气体能使湿润的红色石蕊试纸变蓝 | ||
| C. | 气体与蘸有浓H2SO4的玻璃棒靠近 | D. | 气体与蘸有浓盐酸的玻璃棒靠近 |
5.日常饮水中NO3的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人体健康产生危害.为了降低饮水中NO3-的浓度,某自来水厂设计了如下方案:
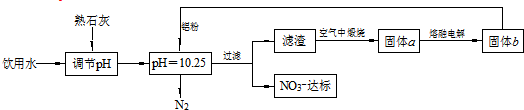
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
15.分子式为C3H4Cl2且含有 结构的有机物的同分异构体共有(不考虑立体异构)( )
结构的有机物的同分异构体共有(不考虑立体异构)( )
 结构的有机物的同分异构体共有(不考虑立体异构)( )
结构的有机物的同分异构体共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
19.S2C12是橡胶工业上常用的硫化剂,是一种金黄色液体.
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+6HCl;③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量氯气制取S2Cl2的装置(部分夹持、加热装置已略去).

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验证明所得产品中是否含有杂质SCl2取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+6HCl;③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 445 | 59 | 137 |
| 沸点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验证明所得产品中是否含有杂质SCl2取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
20.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 1.8g NH4+含有的电子数为0.1NA | |
| B. | 2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA | |
| C. | 标准状况下,11.2L的CCl4所含的分子数为0.5NA | |
| D. | 24.0g O2分子和24g O3分子所含的氧原子数目相等 |
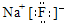 .
.