题目内容
10.下列递变情况中,正确的是( )| A. | C、N、O的原子半径依次减小 | |
| B. | Si、P、S元素的最高正价依次降低 | |
| C. | Na、Mg、Al原子的最外层电子数依次减少 | |
| D. | Li、Na、K的金属性依次减弱 |
分析 A.同周期从左向右原子半径减小;
B.Si、P、S元素的最高正价等于其最外层电子数;
C.同周期从左向右最外层电子数增多;
D.同主族从上到下金属性增强.
解答 解:A.同周期从左向右原子半径减小,则C、N、O的原子半径依次减小,故A正确;
B.Si、P、S元素的最高正价等于其最外层电子数,分别为+4、+5、+6,Si、P、S元素的最高正价依次增大,故B错误;
C.同周期从左向右最外层电子数增多,则Na、Mg、Al原子的最外层电子数依次增大,故C错误;
D.同主族从上到下金属性增强,则Li、Na、K的金属性依次增强,故D错误;
故选A.
点评 本题考查周期表与周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答该题的关键,侧重于学生的分析能力和应用能力的考查,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
20.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 1.8g NH4+含有的电子数为0.1NA | |
| B. | 2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA | |
| C. | 标准状况下,11.2L的CCl4所含的分子数为0.5NA | |
| D. | 24.0g O2分子和24g O3分子所含的氧原子数目相等 |
15.0.3mol Cu2S与足量的浓HNO3反应,生成Cu(NO3)2、H2SO4、NO、H2O,则参加反应的硝酸中,未被还原的硝酸的量是( )
| A. | 75.3g | B. | 2.2mol | C. | 1.2mol | D. | 1mol |
2.下列叙述中能肯定说明金属A比金属B的活泼的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 常温下,与水反应,A浮于水面而B却沉于水底 | |
| C. | 常温时,A能从酸中置换出氢,而B却不能 | |
| D. | 等物质的量的A、B分别从足量酸中置换生成H2:A比B的多 |
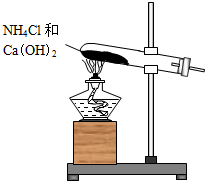 实验室通常用如图所示的装置来制取氨气.
实验室通常用如图所示的装置来制取氨气.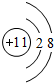 ,
, 制取
制取  ,其合成流程如下:
,其合成流程如下:
 到A的转化是与氢气在催化剂存在条件下的加成反应,请从左向右依次填写其余每步反应所属的类型是b、c、b、c、b.
到A的转化是与氢气在催化剂存在条件下的加成反应,请从左向右依次填写其余每步反应所属的类型是b、c、b、c、b.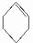 .
.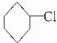 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$