题目内容
13.下列有关化学用语的表述正确的是( )| A. | CO2的比例模型: | |
| B. | N2H4的电子式为: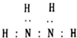 | |
| C. | NaH中氢离子结构示意图为: | |
| D. | 质子数是82,中子数是122的铅原子:${\;}_{82}^{122}$Pb |
分析 A.二氧化碳分子中,碳原子的相对体积应该大于O原子;
B.N2H4中N原子的最外层达到8电子稳定结构;
C.NaH中氢离子核外满足2电子稳定结构;
D.质量数=质子数+中子数,元素符号的左上角为质量数.
解答 解:A.二氧化碳分子中,碳原子的原子半径大于氧原子,其正确的比例模型为: ,故A错误;
,故A错误;
B.N2H4中氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为 ,故B错误;
,故B错误;
C.NaH中氢离子的核电荷数为1,核外电子总数为2,其离子结构示意图为: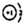 ,故C正确;
,故C正确;
D.质子数是82,中子数是122的铅原子的质量数为204,该原子正确的表示方法为:82204Pb,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、比例模型、离子结构示意图、元素符号等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.下列有关化学用语表示正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: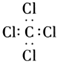 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
1.下列是说法正确的是( )
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
8.下列属于等电子体的是 ( )
| A. | N2O和CO2 | B. | O3和NO2 | C. | CH4和NH3 | D. | OH-和NH2 |
18.下列操作不能用于检验NH3的是( )
| A. | 气体使酚酞试液变红 | B. | 气体能使湿润的红色石蕊试纸变蓝 | ||
| C. | 气体与蘸有浓H2SO4的玻璃棒靠近 | D. | 气体与蘸有浓盐酸的玻璃棒靠近 |
5.日常饮水中NO3的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人体健康产生危害.为了降低饮水中NO3-的浓度,某自来水厂设计了如下方案:
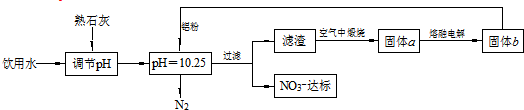
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
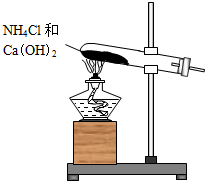 实验室通常用如图所示的装置来制取氨气.
实验室通常用如图所示的装置来制取氨气.