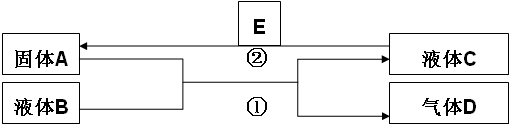
题目内容
12.将10molA和5molB放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2min内,消耗A 3.6mol,则在2min时,C的平均速率是( )| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
分析 根据变化的物质的量之比等于化学计量数之比求出生成的C的物质的量,再根据反应速率v=$\frac{△c}{△t}$计算.
解答 解:在最初2s内,消耗A 3.6mol,变化的物质的量之比等于化学计量数之比,所以生成的C的物质的量为$\frac{2}{3}$×3.6mol=2.4 mol,C的平均速率v=$\frac{△c}{△t}$=$\frac{\frac{2.4mol}{10L}}{2min}$=0.12mol/(L•min),
故选A.
点评 本题考查化学反应速率的简单计算,题目难度不大,注意变化的物质的量之比等于化学计量数之比是解题的关键.

练习册系列答案
相关题目
2.硼有两种天然同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,硼元素的近似相对原子质量为10.80,则${\;}_{5}^{11}$B的质量百分比是( )
| A. | 80% | B. | 大于80% | C. | 小于80% | D. | 无法计算 |
17.${\;}_{6}^{13}$C和${\;}_{6}^{14}$C是碳元素的两种核素,它们具有不同的( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 核外电子排布 |
4.下列有关化学用语表示正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: | |
| C. | 四氯化碳的电子式: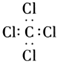 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
1.下列是说法正确的是( )
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
 .
.