题目内容
11.下列有关物质的结构的说法正确的是( )| A. | 3.4g氨气中含有0.6NA个N-H键 | |
| B. | 78g Na2O2晶体中所含阴阳离子个数均为4NA | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 |
分析 A.求出氨气的物质的量,然后根据1mol氨气中含3molN-H键来分析;
B.过氧化钠阴离子为过氧根离子;
C.只含有共价键的物质可能为非金属单质或共价化合物;
D.PCl3分子中所有原子的最外层都达到8电子稳定结构;H2O分子中H原子的最外层电子数为2.
解答 解:A.3.4g氨气的物质的量为0.2mol,而1mol氨气中含3molN-H键,故0.2mol氨气中含0.6molN-H键,故A正确;
B.78g Na2O2晶体物质的量为1mol,含有钠离子2mol,过氧根离子1mol,故B错误;
C.只含有共价键的物质不一定是共价化合物,可能为单质,例如氢气,故C错误;
D.PCl3分子中所有原子的最外层都达到8电子稳定结构;H2O分子中H原子的最外层电子数为2,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意过氧化钠中阴离子为过氧根离子,注意PCl3和H2O分子的结构,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
1.下列是说法正确的是( )
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
2.为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
| A. | Ba(NO3)2--KOH--K2CO3--HNO3 | B. | Ba(NO3)2--KOH--HNO3--K2CO3 | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | K2CO3--Ba(NO3)2--KOH--HNO3 |
19.S2C12是橡胶工业上常用的硫化剂,是一种金黄色液体.
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+6HCl;③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量氯气制取S2Cl2的装置(部分夹持、加热装置已略去).
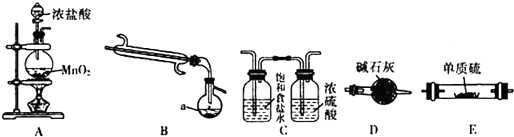
(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验证明所得产品中是否含有杂质SCl2取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+6HCl;③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 445 | 59 | 137 |
| 沸点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验证明所得产品中是否含有杂质SCl2取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
16.下列物质提纯的方法中,正确的是( )
| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
20.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 1.8g NH4+含有的电子数为0.1NA | |
| B. | 2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA | |
| C. | 标准状况下,11.2L的CCl4所含的分子数为0.5NA | |
| D. | 24.0g O2分子和24g O3分子所含的氧原子数目相等 |

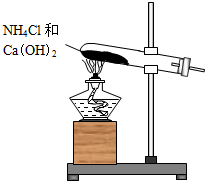 实验室通常用如图所示的装置来制取氨气.
实验室通常用如图所示的装置来制取氨气. 制取
制取  ,其合成流程如下:
,其合成流程如下:
 到A的转化是与氢气在催化剂存在条件下的加成反应,请从左向右依次填写其余每步反应所属的类型是b、c、b、c、b.
到A的转化是与氢气在催化剂存在条件下的加成反应,请从左向右依次填写其余每步反应所属的类型是b、c、b、c、b.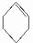 .
.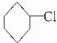 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$