题目内容
1.化学资料表明:H-H、O=O、H-O键的键能分别是436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1,则C(s)+H2O(g)=CO(g)+H2(g)的反应热为( )| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
分析 设C(s)+H2O(g)=CO(g)+H2(g)的△H=akJ•mol-1,根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=H产物-H反应物,再结合化学键能和物质能量的关系列式计算.
解答 解:设C(s)+H2O(g)=CO(g)+H2(g)的△H=akJ•mol-1
已知①C(s)+H2O(g)═CO(g)+H2(g)△H=akJ•mol-1>0,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2a+220)kJ•mol-1,
则:4×462-496-2×436=2a+220,
解得:a=+130.
故选C.
点评 本题考查反应热与焓变的应用,题目难度不大,明确焓变与化学键键能的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
12. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法正确的是( )| A. | 溶液中OH-、导线中的电子都向电极a移动 | |
| B. | N2在正极生成 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 电极b的反应式为O2+4H++4e-=2H2O |
16.在标准状况下,1体积水溶解672体积氨气,所得溶液密度为0.9g•cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
| A. | 17.9mol•L-1 34.7% | B. | 20.4mol•L-1 33.8% | ||
| C. | 17.9mol•L-1 33.8% | D. | 20.4mol•L-1 34.7% |
6.下列有关化学用语表示正确的是( )
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: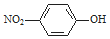 | D. | H2S的电子式: |
13.下列有关化学实验的叙述中,不正确的是( )
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用饱和碳酸钠溶液收集产物 | |
| D. | 制乙烯时,用量程为100℃的温度计代替量程为300℃的温度计,测反应液的温度 |
11.下列图示与对应的叙述不相符合的是( )
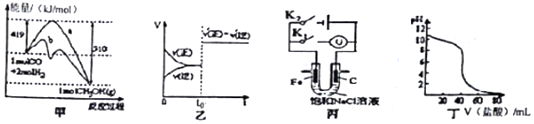

| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
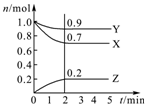 某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
某温度时,在2L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得: